题目内容
【题目】我国某科研机构设计如图装置,利用K2Cr2O7实现含苯酚废水的有效处理,一段时间后,中间室中NaCl溶液的浓度减小。下列说法正确的是( )
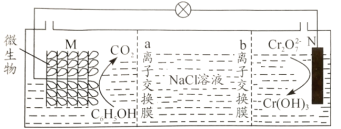
A.M为该电池的正极
B.该装置在高温下处理含苯酚废水效果更佳
C.a为阳离子交换膜,b为阴离子交换膜
D.N电极反应式为:Cr2O![]() +6e-+8H+=2Cr(OH)3↓+H2O
+6e-+8H+=2Cr(OH)3↓+H2O
【答案】C
【解析】
据图可知放电过程中C6H5OH转化为CO2被氧化,所以M电极为负极,Cr2O![]() 转化为Cr(OH)3被还原,所以N电极为正极。
转化为Cr(OH)3被还原,所以N电极为正极。
A.M电极失电子发生氧化反应,为电池的负极,故A错误;
B.高温条件下微生物失活,电池的效率降低,故B错误;
C.放电过程中,苯酚发生氧化反应、作负极,结合电子守恒和电荷守恒可知电极反应式为C6H5OH-28e-+11H2O=6CO2↑+28H+,该装置的目的是对废水进行有效处理,所以废水中不应含有大量氢离子,则负极生成的氢离子要迁移到中间室,所以a为阳离交换膜;正极反应为反应式为:Cr2O![]() +6e-+7H2O=2 Cr(OH)3↓+8OH-,氢氧根要迁移到中间室,所以b为阴离子交换膜;迁移到中间室的氢离子和氢氧根反应生成水使NaCl溶液浓度降低,故C正确;
+6e-+7H2O=2 Cr(OH)3↓+8OH-,氢氧根要迁移到中间室,所以b为阴离子交换膜;迁移到中间室的氢离子和氢氧根反应生成水使NaCl溶液浓度降低,故C正确;
D.N电极为正极,Cr2O![]() 得电子被还原为Cr(OH)3,结合电子守恒和电荷守恒可知电极反应式为Cr2O
得电子被还原为Cr(OH)3,结合电子守恒和电荷守恒可知电极反应式为Cr2O![]() +6e-+7H2O=2 Cr(OH)3↓+8OH-,故D错误;
+6e-+7H2O=2 Cr(OH)3↓+8OH-,故D错误;
故答案为C。

 智慧小复习系列答案
智慧小复习系列答案【题目】下列实验操作、现象和所得结论均正确的是( )
选项 | 实验内容 | 实验结论 |
A | 向盛有5mL0.005mol/L FeCl3溶液中加入5mL0.01mol/LKSCN溶液,再继续加入少量KCl固体,观察现象 | 证明溶液存在平衡: FeCl3+3KSCNFe(SCN)3+3KCl |
B | 取两只试管,分别加入等体积等浓度的双氧水,然后试管①中加入0.01mol/LFeCl3溶液2mL,试管②中加入0.01mol/LCuCl2溶液2mL,试管①产生气泡快 | 加入FeCl3时,双氧水分解反应的活化能较大 |
C | 检验FeCl3溶液中是否含有Fe2+时,将溶液滴入酸性KMnO4溶液,溶液紫红色褪去 | 不能证明溶液中含有Fe2+ |
D | 取两只试管分别加入4mL0.01mol/LKMnO4酸性溶液,然后向一只试管中加入0.01mol/L H2C2O4溶液2mL,向另一只试管中加入0.01mol/L H2C2O4溶液4mL,第一只试管中褪色时间长 | H2C2O4浓度越大,反应速率越快 |
A.AB.BC.CD.D