题目内容
7.关于硫原子核外电子的叙述错误的是( )| A. | 排布在K、L、M三个电子层上 | B. | 3p能级上有2个空轨道 | ||
| C. | 共有16种不同的运动状态 | D. | 共有5种不同的能级 |
分析 A、原子在核外的排布规律:先排K层,再排L层,再依次是M、N等;
B、3p亚层上共有3个轨道,每个轨道排布两个电子;
C、硫原子核外电子的运动状态各不相同;
D、根据硫原子的电子轨道排布理论来回答.
解答 解:A、原子在核外的排布:先排K层2个,再排L层8个,最后排M层是6个,故A正确;
B、3p亚层上共有3个轨道,每个轨道排布两个电子,硫原子的电子排布式为1s22s22p63s23p4,3p亚层上有2个轨道只有一个单电子,无空轨道,故B错误;
C、硫原子的电子排布式为1s22s22p63s23p4,每个轨道中电子的自旋方向相反,则硫原子核外的16个电子的运动状态各不相同,故C正确;
D、硫原子的电子排布式为1s22s22p63s23p4,共有5个轨道上排布电子,共有5种不同能级,故D正确.
故选B.
点评 本题考查了原子的核外电子排布、轨道与能量等,题目难度不大,注意把握核外的排布规律以电子排布式的书写原理.

练习册系列答案
相关题目
18.下列实验能获得成功的是( )
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 | |
| C. | 用溴水可鉴别苯、CCl4、苯乙烯 | |
| D. | 用硝酸银溶液直接检验溴乙烷中的溴元素 |
15.复合材料制成的防弹头盔能抵御多种手枪子弹的射击,最大限度地保护使用人员的安全,下列有关复合材料的性质中,与这一用途有关的是( )
| A. | 高强度、质量轻 | B. | 耐热、抗高温 | C. | 耐腐蚀、稳定性好 | D. | 导电、导热性好 |
2.下列分子的VSEPR模型与分子的立体构型相同的是( )
| A. | H2O | B. | SO32- | C. | NH3 | D. | CCl4 |
12.化学与社会、科学、技术、环境密切相关.下列说法不正确的是( )
| A. | 预防H7N9流感病毒的措施之一是高温消毒餐具等生活日用品 | |
| B. | 大气中直径小于或等于2.5微米的颗粒物(PM2.5)会造成空气污染,应加强监测和治理 | |
| C. | 我国京津冀等城市实施SO2、CO2、NO2、N2等大气污染物排放限制 | |
| D. | 积极推广太阳能、风能、地热能等新能源的使用,减少化石燃料的使用,有效降低PM2.5对环境的污染 |
19.下列化合物中只有离子键的是( )
| A. | MgCl2 | B. | Na2O2 | C. | KHSO4 | D. | NH4Cl |
17.下列试剂:①浓氨水 ②氯水 ③硝酸银 ④浓硝酸 ⑤浓盐酸 ⑥溴化银,其中必须用棕色试剂瓶盛装的有( )
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③⑤⑥ | D. | ①③④⑤ |
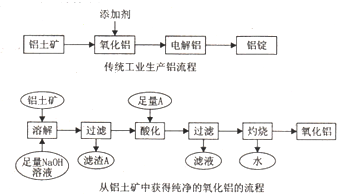
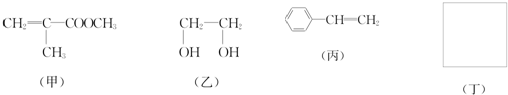
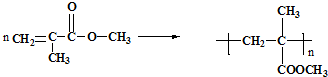
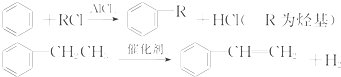 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是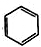 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$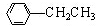 +HCl.
+HCl.