题目内容
6.A、B、C、D、E、F元素是原子序数依次增大的六种短周期元素.已知:元素A的原子半径在所有元素中最小,元素B的 一种同位素可测定文物年代,D原子最外层电子数与核外电子总数之比为3:4,D和E可以形1:1和1:2的两种离子化合物,F是同周期中简单离子中半径最小的元素,元素F离子结构示意图为 .E在元素周期表中的位置第三周期IA族.
.E在元素周期表中的位置第三周期IA族.
分析 A、B、C、D、E、F元素是原子序数依次增大的六种短周期元素.元素A的原子半径在所有元素中最小,则A为H元素;元素B的 一种同位素可测定文物年代,则B为碳元素;D原子最外层电子数与核外电子总数之比为3:4,则D为O元素;C元素原子序数介于碳、氧之间,则C为N元素;D和E可以形1:1和1:2的两种离子化合物,则E为Na;F是同周期中简单离子中半径最小的元素,则F为Al.
解答 解:A、B、C、D、E、F元素是原子序数依次增大的六种短周期元素.元素A的原子半径在所有元素中最小,则A为H元素;元素B的 一种同位素可测定文物年代,则B为碳元素;D原子最外层电子数与核外电子总数之比为3:4,则D为O元素;C元素原子序数介于碳、氧之间,则C为N元素;D和E可以形1:1和1:2的两种离子化合物,则E为Na;F是同周期中简单离子中半径最小的元素,则F为Al.
元素F离子为Al3+,Al3+结构示意图为 ,E为Na,在元素周期表中的位置:第三周期IA族,
,E为Na,在元素周期表中的位置:第三周期IA族,
故答案为: ;第三周期IA族.
;第三周期IA族.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
16.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | NA个氧分子与NA个氢分子的质量之比为8:1 | |
| B. | 100mL 1.0mol•L-1FeCl3溶液与足量Cu反应,转移的电子数为0.2NA | |
| C. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA | |
| D. | NA个D2O分子中,含有10NA个电子 |
17.铝电池性能优越,Al-AgO电池主要用于军用水下动力,其工作原理如图所示.下列有关Al-AgO电池的说法错误的是( )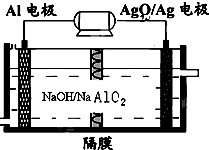

| A. | 正极反应中有Ag生成 | |
| B. | OH-通过隔膜从正极区移向负极区 | |
| C. | 消耗5.4g Al时,电路中转移0.6mol e- | |
| D. | 电池总反应为:2Al+3AgO=Al2O3+3Ag |
1. 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.
(1)一定温度下,向容积恒定为2L的密闭容器中通入3mol CO2、3mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等,请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/L•min;
②此时温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC(填选项字母)
A.v正(CH4)=2v逆(H2)
B.容器内压强保持恒定不变
C.反应中断裂2molC-H键同时消耗1mol H2
D.容器内混合气体的密度保持恒定不变
④已知:
则反应CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=248KJ/mol.
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度(写两点).
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
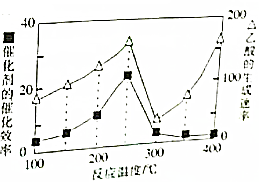
①在不同温度下乙酸的生成速率如图苏搜:在250-400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,催化剂的催化效率降低.
②在250℃与400℃时乙酸的生成速率相近,请分析判断实际生产选择的最佳温度是250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动.
 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.(1)一定温度下,向容积恒定为2L的密闭容器中通入3mol CO2、3mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等,请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/L•min;
②此时温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC(填选项字母)
A.v正(CH4)=2v逆(H2)
B.容器内压强保持恒定不变
C.反应中断裂2molC-H键同时消耗1mol H2
D.容器内混合气体的密度保持恒定不变
④已知:
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(KJ/mol) | 286 | 283 | 890 | 874 |
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度(写两点).
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图苏搜:在250-400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,催化剂的催化效率降低.
②在250℃与400℃时乙酸的生成速率相近,请分析判断实际生产选择的最佳温度是250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动.
18.下列变化过不需另外加人氧化剂或还原剂就能实现的有( )
| A. | Cl-→Cl2 | B. | Fe3+→Fe2+ | C. | KClO3→KCl | D. | KI→I2 |
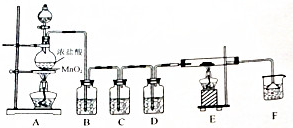 实验室中所用少量氯气用如图装置制取,请回答下列问题:
实验室中所用少量氯气用如图装置制取,请回答下列问题: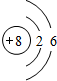 ;
;