题目内容
1. 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.(1)一定温度下,向容积恒定为2L的密闭容器中通入3mol CO2、3mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等,请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/L•min;
②此时温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC(填选项字母)
A.v正(CH4)=2v逆(H2)
B.容器内压强保持恒定不变
C.反应中断裂2molC-H键同时消耗1mol H2
D.容器内混合气体的密度保持恒定不变
④已知:
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(KJ/mol) | 286 | 283 | 890 | 874 |
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度(写两点).
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图苏搜:在250-400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,催化剂的催化效率降低.
②在250℃与400℃时乙酸的生成速率相近,请分析判断实际生产选择的最佳温度是250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动.
分析 结合化学平衡三段式列式计算,一定温度下,向容积恒定为2L的密闭容器中通入3mol CO2、3mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等,设反应达到平衡状态消耗二氧化碳浓度为x,
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始量(mol/L) 1.5 1.5 0 0
变化量(mol/L) x x 2x 2x
平衡量(mol/L)1.5-x 1.5-x 2x 2x
此时测得CO2和 CO的体积分数相等,浓度相同,则1.5-x=2x
x=0.5mol/L
(1)①氢气反应速率V=$\frac{△c}{△t}$=
②平衡常数等于配合状态下生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,结合化学平衡三段式列式计算平衡浓度;
③根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
④依据燃烧热概念书写三种气体的燃烧热的热化学方程式,依据盖斯定律计算得到所需热化学方程式得到反应焓变;
⑤根据外界条件对化学平衡的影响,平衡正向移动,反应物甲烷转化率增大;
(2)①根据温度对催化剂活性的影响;
②从综合经济效益考虑,是因为250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动.
解答 解:结合化学平衡三段式列式计算,一定温度下,向容积恒定为2L的密闭容器中通入3mol CO2、3mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等,设反应达到平衡状态消耗二氧化碳浓度为x,
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始量(mol/L) 1.5 1.5 0 0
变化量(mol/L) x x 2x 2x
平衡量(mol/L)1.5-x 1.5-x 2x 2x
此时测得CO2和 CO的体积分数相等,浓度相同,则1.5-x=2x
x=0.5mol/L
(1)①2min内,用H2来表示的反应速率v(H2)=$\frac{2×0.5mol/L}{2min}$=0.5mol/L•min,
故答案为:0.5mol/L•min;
②平衡常数K=$\frac{{c}^{2}(CO){c}^{2}({H}_{2})}{c(C{O}_{2})c(C{H}_{4})}$=$\frac{(2×0.5)^{2}×(2×0.5)^{2}}{(1.5-0.5)(1.5-0.5)}$=1,
故答案为:1;
③CO2(g)+CH4(g)?2CO(g)+2H2(g),反应是气体体积增大的反应,
A.速率之比等于化学方程式计量数之比,2v正(CH4)=v正(H2),当2v正(CH4)=v逆(H2),反应达到平衡状态,但v正(CH4)=2v逆(H2)不符合速率之比,不能说明反应达到平衡状态,故A错误;
B.反应前后气体物质的量变化,当容器内压强保持恒定不变,说明反应达到平衡状态,故B正确;
C.反应中断裂4molC-H键同时消耗2mol H2 ,说明反应达到平衡状态,反应中断裂2molC-H键同时消耗1mol H2,说明反应达到平衡状态,故C正确;
D.反应前后气体质量和体积不变,容器内混合气体的密度始终保持恒定不变不能说明反应达到平衡状态,故D错误;
故选BC.
④氢气燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol ①
CO燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol ②
CH4燃烧热的热化学方程式为:CH4(g)+2O2(g)→CO2(g)+2H2O(l) )△H=-890KJ/mol ③
依据盖斯定律计算,③-②×2+①×2得到反应的热化学方程式为:CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=248KJ/mol,
故答案为:248KJ/mol;
⑤反应是气体体积增大的反应,减小反应压强、增大CO2的浓度,平衡正向移动,反应物甲烷的转化率增大,
故答案为:减小反应压强、增大CO2的浓度;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,是因为250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动,故答案为:250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动.
点评 本题考查热化学反应方程式计算、速率概念和化学化学平衡常数的相关计算、化学平衡移动原理应用,综合性很强,难度中等.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | 第二周期ⅣA族 | B. | 第三周期ⅣA族 | C. | 第三周ⅥA族 | D. | 第二周期ⅣA族 |
| A. | H+、Fe2+、NO${\;}_{3}^{-}$、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 4.9×10-10 | 7.2×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(1)“粉碎”的目的是增大接触面积,加快反应速率,提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2.“酸浸”的适宜温度与时间分别为c(填字母).
a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象 是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).
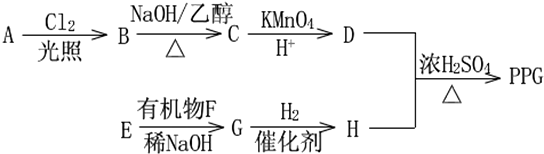

 .
. .
. .
. .
. .E在元素周期表中的位置第三周期IA族.
.E在元素周期表中的位置第三周期IA族.