题目内容
【题目】常温时,将![]() 的氨水滴加到
的氨水滴加到![]() 的盐酸中,下列说法正确的是 ( )
的盐酸中,下列说法正确的是 ( )
A.若混合溶液中![]() ,则
,则![]()
B.若混合液中![]() ,则
,则![]()
C.若混合液中![]() ,则混合液的pH<7
,则混合液的pH<7
D.若![]() ,且混合液的pH<7,则一定
,且混合液的pH<7,则一定![]()
【答案】A
【解析】
A.若混合液中c(NH4)=c(Cl-),根据电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),则c(H+)=c(OH-),要使氨水和盐酸的混合溶液呈中性,则氨水应该稍微过量,所以c1V1>c2V2,故A正确;
B.根据A中分析可知B错误;
C.溶液中存在电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),若c(NH4+)>c(Cl-),则c(H+)<c(OH-),混合液的pH>7,故C错误;
D.若V1=V2,且混合液的pH<7,说明c(H+)>c(OH-),如果二者恰好反应,等物质的量的氨水和氯化氢恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其溶液呈酸性,此时c1=c2,故D错误;
故选A。

练习册系列答案
相关题目
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
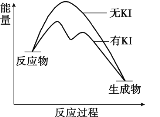
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性