题目内容
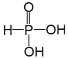
【题目】某溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子,且所含有的离子浓度均为
中的若干种离子,且所含有的离子浓度均为![]() 。某同学为确定其成分,进行如图所示实验:
。某同学为确定其成分,进行如图所示实验:
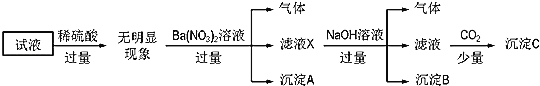
下列说法正确的是( )
A.无法确定原试液中是否含有![]() 、
、![]()
B.滤液X中大量存在的阳离子有![]() 、
、![]() 和
和![]()
C.无法确定沉淀C的成分
D.原溶液中存在的离子为![]() 、
、![]() 、
、![]() 、
、![]()
【答案】D
【解析】
加稀硫酸无明显现象,说明溶液中无![]() ,加入过量硝酸钡产生了沉淀A,则沉淀A为
,加入过量硝酸钡产生了沉淀A,则沉淀A为![]() ,产生的气体根据题目限制的条件只能是氮氧化物,则溶液中必有
,产生的气体根据题目限制的条件只能是氮氧化物,则溶液中必有![]() ,AlO2-和
,AlO2-和![]() 不共存,所以没有AlO2-。加入过量的碱能产生气体,则只能是氨气,溶液中必有
不共存,所以没有AlO2-。加入过量的碱能产生气体,则只能是氨气,溶液中必有![]() ,此时产生的沉淀B为
,此时产生的沉淀B为![]() ,最终通入少量二氧化碳,产生的沉淀C中必然有
,最终通入少量二氧化碳,产生的沉淀C中必然有![]() ,接下来根据电荷守恒来判断,已确定的离子有
,接下来根据电荷守恒来判断,已确定的离子有![]() 、
、![]() 、
、![]() ,已知离子的物质的量相等,根据电荷守恒,一定存在
,已知离子的物质的量相等,根据电荷守恒,一定存在![]() ,
,![]() 和
和![]() 都不能存在。
都不能存在。
A.一定存在![]() ,
,![]() 一定不存在,A项错误;
一定不存在,A项错误;
B.X中不可能有![]() ,此时溶液中的
,此时溶液中的![]() 已经全部被氧化为
已经全部被氧化为![]() ,B项错误;
,B项错误;
C.沉淀C为![]() ,C项错误;
,C项错误;
D.根据以上分析,D项正确;
答案选D。

练习册系列答案
相关题目