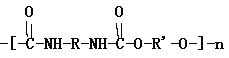题目内容
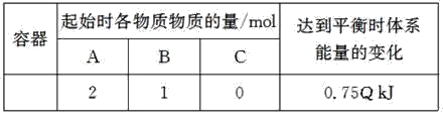
【题目】T℃时,体积为0.5L的恒容密闭容器中发生可逆反应:2A(g)+B(g)![]() 2C(g) ΔH=-QkJ·mol-1(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如表:
2C(g) ΔH=-QkJ·mol-1(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如表:
其他条件不变,若容器保持恒容绝热,则达到平衡时C的体积分数____![]() (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。
【答案】<
【解析】
热化学方程式的反应热表示反应物完全转化为生成物时的能量变化,根据反应放出的热量,可计算出反应的反应物及产生的C的物质的量,最后根据物质的体积分数等于该物质的物质的量占总物质的量的百分比,再与![]() 比较判断。
比较判断。
热化学方程式2A(g)+B(g)![]() 2C(g) ΔH=-QkJ/mol表示2molA完全反应放出QkJ的能量,根据表格数据可知物质容器中参加反应的A的物质的量△n(A)=2mol×
2C(g) ΔH=-QkJ/mol表示2molA完全反应放出QkJ的能量,根据表格数据可知物质容器中参加反应的A的物质的量△n(A)=2mol×![]() =1.5mol,则根据物质反应关系可知B反应的物质的量是△n(B)=
=1.5mol,则根据物质反应关系可知B反应的物质的量是△n(B)=![]() △n(A)=0.75mol,反应产生C的物质的量为△n(C)=△n(A)=1.5mol,所以平衡时各种物质的物质的量n(A)=2mol-1.5mol=0.5mol,n(B)=1mol-0.75mol=0.25mol,n(C)=1.5mol,所以平衡时C的体积分数为
△n(A)=0.75mol,反应产生C的物质的量为△n(C)=△n(A)=1.5mol,所以平衡时各种物质的物质的量n(A)=2mol-1.5mol=0.5mol,n(B)=1mol-0.75mol=0.25mol,n(C)=1.5mol,所以平衡时C的体积分数为![]() ×100%=
×100%=![]() 。其他条件不变,因容器保持恒容绝热,随反应进行,容器的温度升高,升高温度,化学平衡向吸热的逆反应方向移动,导致C的物质的量减少,混合气体的物质的量增多,因此最终平衡C的体积分数小于
。其他条件不变,因容器保持恒容绝热,随反应进行,容器的温度升高,升高温度,化学平衡向吸热的逆反应方向移动,导致C的物质的量减少,混合气体的物质的量增多,因此最终平衡C的体积分数小于![]() 。
。

【题目】实验室制备叔丁基苯(![]() )的反应和有关数据如下:
)的反应和有关数据如下:
![]() +ClC(CH3)3
+ClC(CH3)3![]()
![]() +HCl
+HCl
物质 | 相对分子质量 | 密度/gcm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
AlCl3 | —— | —— | 190 | 易升华 | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88 | —— | 80.1 | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.85 | —— | 51.6 | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 | —— | 169 | 难溶于水,易溶于苯 |
I.如图是实验室制备无水AlCl3可能需要的装置:
A.  B.
B. 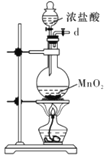 C.
C. 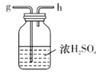 D.
D.  E.
E.  F.
F. 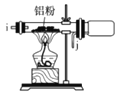
(1)检查B装置气密性的方法是__________。
(2)制备无水AlCl3的装置的合理的连接顺序为________(填小写字母),其中E装置的作用是___________。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是________。
II.如图是实验室制备叔丁基苯的装置(夹持装置略):

在三颈烧瓶中加入50mL的苯和适量的无水AlCl,由恒压漏斗滴加氯代叔丁烷10 mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20 g。
使用恒压漏斗的优点是_________;加入无水MgSO4固体的作用是____________________________________。
(5)洗涤混合物时所用的试剂有如下三种,正确的使用顺序是__________(填序号)
①5%的Na2CO3溶液 ②稀盐酸 ③H2O
(6)本实验中叔丁基苯的产率为______________(保留3位有效数字)