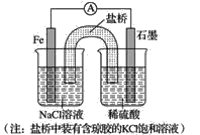
题目内容
【题目】某溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子,且所含有的离子浓度均为
中的若干种离子,且所含有的离子浓度均为![]() 。某同学为确定其成分,进行如图所示实验:
。某同学为确定其成分,进行如图所示实验:
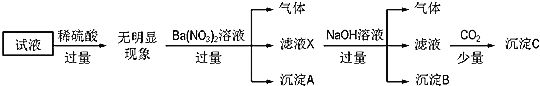
下列说法正确的是( )
A.无法确定原试液中是否含有![]() 、
、![]()
B.滤液X中大量存在的阳离子有![]() 、
、![]() 和
和![]()
C.无法确定沉淀C的成分
D.原溶液中存在的离子为![]() 、
、![]() 、
、![]() 、
、![]()
【答案】D
【解析】
加稀硫酸无明显现象,说明溶液中无![]() ,加入过量硝酸钡产生了沉淀A,则沉淀A为
,加入过量硝酸钡产生了沉淀A,则沉淀A为![]() ,产生的气体根据题目限制的条件只能是氮氧化物,则溶液中必有
,产生的气体根据题目限制的条件只能是氮氧化物,则溶液中必有![]() ,AlO2-和
,AlO2-和![]() 不共存,所以没有AlO2-。加入过量的碱能产生气体,则只能是氨气,溶液中必有
不共存,所以没有AlO2-。加入过量的碱能产生气体,则只能是氨气,溶液中必有![]() ,此时产生的沉淀B为
,此时产生的沉淀B为![]() ,最终通入少量二氧化碳,产生的沉淀C中必然有
,最终通入少量二氧化碳,产生的沉淀C中必然有![]() ,接下来根据电荷守恒来判断,已确定的离子有
,接下来根据电荷守恒来判断,已确定的离子有![]() 、
、![]() 、
、![]() ,已知离子的物质的量相等,根据电荷守恒,一定存在
,已知离子的物质的量相等,根据电荷守恒,一定存在![]() ,
,![]() 和
和![]() 都不能存在。
都不能存在。
A.一定存在![]() ,
,![]() 一定不存在,A项错误;
一定不存在,A项错误;
B.X中不可能有![]() ,此时溶液中的
,此时溶液中的![]() 已经全部被氧化为
已经全部被氧化为![]() ,B项错误;
,B项错误;
C.沉淀C为![]() ,C项错误;
,C项错误;
D.根据以上分析,D项正确;
答案选D。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】氮及其化合物在工农业生产、生活中有着重要应用。
(1)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
N2(g)+O2(g)═2NO(g) | b | K2 |
则CH4脱硝的热化学方程式为CH4(g) + 4NO (g)CO2(g) + 2N2(g) + 2H2O ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
(2)用活性炭还原法可以消除NO 的污染,发生的反应为C(s)+2NO(g)N2(g)+CO2(g)。1molNO 和足量的活性炭在T℃、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为0.4mol。
①从反应开始到5min,用氮气表示的平均反应速率为_________。达到平衡后,向容器中再通入0.1molNO气体和0.3molCO2气体,则此平衡将_________(填“正向移动”“不移动”或“逆向移动”)。
②能判断该反应一定达到化学平衡状态的依据是_________(填标号)。
a.NO和N2的体积比保持不变
b.单位时间内生成2nmolNO的同时消耗nmolCO2
c.恒温恒容条件下,反应体系的压强不再发生改变
d.恒容条件下,混合气体的平均相对分子质量不变
(3)某实验小组模拟4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200kJ·mol-1净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙(填“>、=、<或不确定”)
甲 | 乙 |
0.2molNO2 | 0.1molNO2 |
0.4molCO | 0.2molCO |
【题目】实验室制备叔丁基苯(![]() )的反应和有关数据如下:
)的反应和有关数据如下:
![]() +ClC(CH3)3
+ClC(CH3)3![]()
![]() +HCl
+HCl
物质 | 相对分子质量 | 密度/gcm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
AlCl3 | —— | —— | 190 | 易升华 | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88 | —— | 80.1 | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.85 | —— | 51.6 | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 | —— | 169 | 难溶于水,易溶于苯 |
I.如图是实验室制备无水AlCl3可能需要的装置:
A.  B.
B. 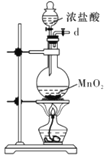 C.
C. 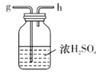 D.
D.  E.
E.  F.
F. 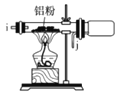
(1)检查B装置气密性的方法是__________。
(2)制备无水AlCl3的装置的合理的连接顺序为________(填小写字母),其中E装置的作用是___________。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是________。
II.如图是实验室制备叔丁基苯的装置(夹持装置略):

在三颈烧瓶中加入50mL的苯和适量的无水AlCl,由恒压漏斗滴加氯代叔丁烷10 mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20 g。
使用恒压漏斗的优点是_________;加入无水MgSO4固体的作用是____________________________________。
(5)洗涤混合物时所用的试剂有如下三种,正确的使用顺序是__________(填序号)
①5%的Na2CO3溶液 ②稀盐酸 ③H2O
(6)本实验中叔丁基苯的产率为______________(保留3位有效数字)