题目内容
2.某同学在学习了乙酸的性质后,根据甲酸的结构(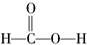 )对甲酸的化学性质进行了下列推断,其中不正确的是( )
)对甲酸的化学性质进行了下列推断,其中不正确的是( )| A. | 能与碳酸钠溶液反应 | B. | 能发生银镜反应 | ||
| C. | 不能使酸性KMnO4溶液褪色 | D. | 能与单质镁反应 |
分析 该物质中含有醛基、羧基,所以具有醛和羧酸的性质,能发生氧化反应、银镜反应、酯化反应、取代反应、中和反应等,据此分析解答.
解答 解:A.含有羧基,所以能与 碳酸钠反应生成二氧化碳,故A正确;
B.含有醛基,所以能与银氨溶液发生银镜反应,故B正确;
C.含有醛基,所以能被酸性高锰酸钾溶液氧化,故C错误;
D.含有羧基,所以能和Mg反应生成氢气,故D正确;
故选C.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,注意该物质虽然是羧酸,但含有醛基,所以能发生银镜反应,易错选项是BC.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
7.下列物质中,既能发生消去反应,又能催化氧化生成醛的是( )
| A. | CH3OH | B. | C2H5OH | C. | (CH3)3COH | D. | (CH3)3CCH2OH |
13.X、Y、Z、T四种原子序数递增的短周期元素,其部分性质或结构如下:
下列说法正确的是( )
| 元素编号 | 元素性质或原子结构 |
| X | 形成的简单阳离子核外无电子 |
| Y | 元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应 |
| Z | 元素在周期表的族序数等于周期序数的3倍 |
| T | 同周期元素中形成的简单离子半径最小 |
| A. | 原子半径大小顺序:T>Z>Y>X | |
| B. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液反应生成氢气 | |
| C. | X分别与Y、Z均可形成既含极性键又含非极性键的化合物 | |
| D. | 由X、Y和Z三种元素构成的强电解质,对水电离均起抑制作用 |
10.下列物质中,与CH3-CH=CH-CH3互为同分异构体的是( )
| A. | CH3CH2CH2CH3 | B. | 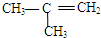 | C. | 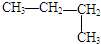 | D. | CH3-CH=CH2 |
17.如表实验装置示意图、实验现象及解释均正确的是( )
| A | B | C | D | |
实验 | 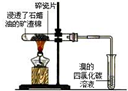 | 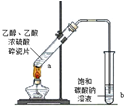 | 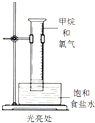 |  |
| 现象 | 溴的四氯化碳溶液褪色 | 试管b中出现分层现象 | 量筒内壁产生油状液滴 | 反应过程中钠未熔化成小球 |
解释 | 石蜡油分解产物中 仅含有烯烃 | 反应生成难溶于饱和碳酸钠 溶液的乙酸乙酯 | 甲烷和氯气反应,生成了CH2Cl2、CHCl3、CCl4 | 反应吸热 |
| A. | A | B. | B | C. | C | D. | D |
7.将一定量的甲烷和氧气的混合气体置于装有过氧化钠的密闭容器中,用电火花点燃,充分反应后,在1.01×105Pa,120℃时,测得容器中的压强几乎为零,将反应后的剩余固体投入水中也未见有气泡出现.则下列判断中不正确的是( )
| A. | 反应后剩余气体的成分是碳酸钠和氢氧化钠 | |
| B. | 原来混合气体中甲烷和氧气的体积比2:1 | |
| C. | 原来混合气体中甲烷与氧气的体积比为1:2 | |
| D. | 原来的密闭容器中,甲烷、氧气、过氧化钠的物质的量之比为2:1:6 |
14.原子序数小于18的八种连号元素,它们单质的熔点随原子序数增大而变化的趋势如图所示.图中X元素应属( )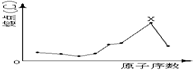

| A. | ⅢA族 | B. | ⅣA族 | C. | ⅤA族 | D. | ⅥA族 |
11.甲、乙、丙、丁都是短周期元素,其中甲、丁在周期表中的相对位置如下表,甲原子最外层电子数是其内层电子数的2倍,乙单质在空气中燃烧发出黄色火焰,丙是地壳中含量最高的金属元素.下列判断正确的是( )
| 甲 | ||
| 丁 |
| A. | 简单离子半径:乙>丁 | |
| B. | 乙与氧元素形成的某化合物中可能既有离子键,又有共价键 | |
| C. | 乙、丙、丁三种元素最高价氧化物的水化物两两之间能发生反应 | |
| D. | 甲与丁的核外电子数相差8 |
12.分子式为C5H12O的醇与某一元羧酸发生酯化反应,该醇与该羧酸的相对分子质量相同.不考虑立体异构,其反应生成的酯共有( )
| A. | 15种 | B. | 16种 | C. | 17种 | D. | 18种 |