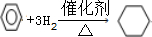
题目内容
11.甲、乙、丙、丁都是短周期元素,其中甲、丁在周期表中的相对位置如下表,甲原子最外层电子数是其内层电子数的2倍,乙单质在空气中燃烧发出黄色火焰,丙是地壳中含量最高的金属元素.下列判断正确的是( )| 甲 | ||
| 丁 |
| A. | 简单离子半径:乙>丁 | |
| B. | 乙与氧元素形成的某化合物中可能既有离子键,又有共价键 | |
| C. | 乙、丙、丁三种元素最高价氧化物的水化物两两之间能发生反应 | |
| D. | 甲与丁的核外电子数相差8 |
分析 甲、乙、丙、丁都是短周期元素,甲原子最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故甲为C元素;由甲、丁在周期表中的相对位置,可知丁为Cl;乙单质在空气中燃烧发出黄色火焰,则乙为Na;丙是地壳中含量最高的金属元素,则丙为Al,据此解答.
解答 解:甲、乙、丙、丁都是短周期元素,甲原子最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故甲为C元素;由甲、丁在周期表中的相对位置,可知丁为Cl;乙单质在空气中燃烧发出黄色火焰,则乙为Na;丙是地壳中含量最高的金属元素,则丙为Al,
A.乙、丁的简单离子分别为Na+、Cl-,Na+离子比Cl-离子少一个电子层,故离子半径:Na+<Cl-,故A错误;
B.乙与氧元素形成的某化合物有氧化钠、过氧化钠,过氧化钠中既有离子键,又有共价键,故B正确;
C.乙、丙、丁三种元素最高价氧化物的水化物分别为氢氧化钠、氢氧化铝、高氯酸,氢氧化铝属于两性氢氧化物,能与氢氧化钠、高氯酸反应,氢氧化钠与高氯酸发生中和反应,故C正确;
D.甲为C、丁为Cl,二者核外电子数之差为17-6=11,故D错误,
故选BC.
点评 本题考查结构性质位置关系应用,比较基础,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
2.某同学在学习了乙酸的性质后,根据甲酸的结构(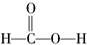 )对甲酸的化学性质进行了下列推断,其中不正确的是( )
)对甲酸的化学性质进行了下列推断,其中不正确的是( )
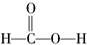 )对甲酸的化学性质进行了下列推断,其中不正确的是( )
)对甲酸的化学性质进行了下列推断,其中不正确的是( )| A. | 能与碳酸钠溶液反应 | B. | 能发生银镜反应 | ||
| C. | 不能使酸性KMnO4溶液褪色 | D. | 能与单质镁反应 |
6.食品香精菠萝酯的生产路线(反应条件略去)如下:下列叙述正确的是( )
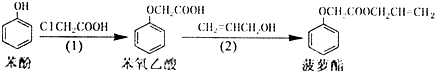
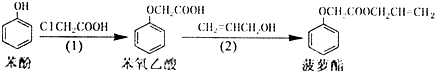
| A. | 步骤(1)、(2)的反应类型不同 | |
| B. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| C. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| D. | 步骤(2)产物中残留的烯丙醇可用溴水检验 |
16.下列实验结论正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 食醋浸泡水垢 | 产生无色气体 | 乙酸的氧化性比碳酸强 |
| B | 乙醇与橙色酸性重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇化合态碘变蓝 |
| D | 新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀 | 葡萄糖具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
3.下列关于H2NCH2COOH和CH3CH2NO2的说法不正确的是( )
| A. | 都是有机物 | B. | 都是共价化合物 | C. | 都是离子化合物 | D. | 互为同分异构体 |
20.恒容恒温条件下,可逆反应H2(g)+I2(g)═2HI(g) 达到平衡的标志是( )
| A. | 混合气体的颜色不再改变 | B. | H2、I2、HI的浓度相等 | ||
| C. | 混合气体的密度保持不变 | D. | H2、I2、HI分子个数比为1:1:2 |
1.在元素周期表的短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
| A. | XY3晶体一定是离子晶体 | |
| B. | 若Y的原子序数为m,X的原子序数可能是m±4 | |
| C. | X和Y可属于同一周期,不可属于两个不同周期 | |
| D. | X和Y一定不属于同一主族 |
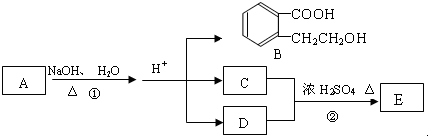
 .(不用写条件)
.(不用写条件)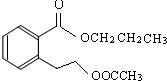 .
.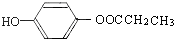 .
.