题目内容
(14分)运用化学反应原理研究NH3的性质具有重要意义。
(1)科学家一直致力于“人工固氮”的新方法研究。据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质。在使用催化剂b和不使用催化剂a时,该反应过程和能量的变化关系如图所示。

①写出该反应的化学方程式 。
②a和b相比,二者的平衡常数关系是Ka Kb(填“>”、“=”或“<”)
③升高温度,平衡时NH3的含量 (填“增大”、“不变”或“减小”)
(2)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g) + 3H2(g) 2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”)
2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”)
(3)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
①则2 ~4min内,v(O2) = 。
②在第8min时改变条件,你认为改变的条件可能是 。
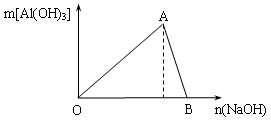
(4)常温下,向0.001 mol·L-1的AlCl3溶液中通入NH3直至过量,现象 ,当PH = 时,开始生成沉淀(已知:Ksp[Al(OH)3]= 1.0×10-33)。
(1)科学家一直致力于“人工固氮”的新方法研究。据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质。在使用催化剂b和不使用催化剂a时,该反应过程和能量的变化关系如图所示。

①写出该反应的化学方程式 。
②a和b相比,二者的平衡常数关系是Ka Kb(填“>”、“=”或“<”)
③升高温度,平衡时NH3的含量 (填“增大”、“不变”或“减小”)
(2)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g) + 3H2(g)
 2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”)
2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”)(3)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
 浓度mol.L-1 浓度mol.L-1时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
②在第8min时改变条件,你认为改变的条件可能是 。
(4)常温下,向0.001 mol·L-1的AlCl3溶液中通入NH3直至过量,现象 ,当PH = 时,开始生成沉淀(已知:Ksp[Al(OH)3]= 1.0×10-33)。
(1)① 2N2 + 6H2O 
 4NH3 + 3O2 (2分)
4NH3 + 3O2 (2分)
② = (1分) ③增大 (1分)
(2) < (2分)
(3)① 0.0625 mol/(L·min) (2分)
②增大NO的浓度(或增加NO的物质的量) (2分)
(4)生成白色沉淀 (2分) 4 (2分)

 4NH3 + 3O2 (2分)
4NH3 + 3O2 (2分) ② = (1分) ③增大 (1分)
(2) < (2分)
(3)① 0.0625 mol/(L·min) (2分)
②增大NO的浓度(或增加NO的物质的量) (2分)
(4)生成白色沉淀 (2分) 4 (2分)
(1)①根据反应前后原子守恒可知,单质是氧气,所以反应式为2N2 + 6H2O 
 4NH3 + 3O2。
4NH3 + 3O2。
②催化剂能降低反应的活化能,但不能改变平衡常数,所以平衡常数是不变的。
③根据图像可知,反应物的总能量低于生成物的总能量,反应是吸热反应。升高温度平衡向正反应方向移动,氨气的含量增大。
(2)某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则其浓度分别为4.0mol/L、2.0mol/L、6.0mol/L。所以此时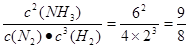 >0.5,所以反应逆反应方向移动,即正反应速率小于逆反应速率。
>0.5,所以反应逆反应方向移动,即正反应速率小于逆反应速率。
(3)①氨气发生催化氧化的方程式为4NH3+5O2 4NO+6H2O,在2 ~4min内,氨气浓度的变化量是0.600mol/L-0.500mol/L=0.100mol/L,所以氧气的浓度变化量是0.125mol/L,则反应速率为
4NO+6H2O,在2 ~4min内,氨气浓度的变化量是0.600mol/L-0.500mol/L=0.100mol/L,所以氧气的浓度变化量是0.125mol/L,则反应速率为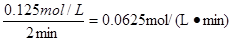 。
。
②4min时反应达到平衡状态,而在第8min时,氨气、氧气和NO的浓度均增大,所以只能是增大了生成物NO的浓度,平衡向逆反应方向移动。
(4)根据氢氧化铝的溶度积常数可知当铝离子浓度是0.001mol/L时,溶液中OH-的浓度为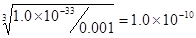 ,则氢离子浓度为10-4,所以pH等于4.
,则氢离子浓度为10-4,所以pH等于4.

 4NH3 + 3O2。
4NH3 + 3O2。②催化剂能降低反应的活化能,但不能改变平衡常数,所以平衡常数是不变的。
③根据图像可知,反应物的总能量低于生成物的总能量,反应是吸热反应。升高温度平衡向正反应方向移动,氨气的含量增大。
(2)某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则其浓度分别为4.0mol/L、2.0mol/L、6.0mol/L。所以此时
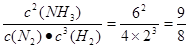 >0.5,所以反应逆反应方向移动,即正反应速率小于逆反应速率。
>0.5,所以反应逆反应方向移动,即正反应速率小于逆反应速率。(3)①氨气发生催化氧化的方程式为4NH3+5O2
 4NO+6H2O,在2 ~4min内,氨气浓度的变化量是0.600mol/L-0.500mol/L=0.100mol/L,所以氧气的浓度变化量是0.125mol/L,则反应速率为
4NO+6H2O,在2 ~4min内,氨气浓度的变化量是0.600mol/L-0.500mol/L=0.100mol/L,所以氧气的浓度变化量是0.125mol/L,则反应速率为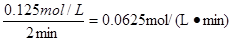 。
。②4min时反应达到平衡状态,而在第8min时,氨气、氧气和NO的浓度均增大,所以只能是增大了生成物NO的浓度,平衡向逆反应方向移动。
(4)根据氢氧化铝的溶度积常数可知当铝离子浓度是0.001mol/L时,溶液中OH-的浓度为
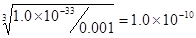 ,则氢离子浓度为10-4,所以pH等于4.
,则氢离子浓度为10-4,所以pH等于4.
练习册系列答案
相关题目
 的原料。已知:
的原料。已知: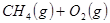



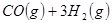




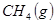 与
与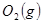 反应生成
反应生成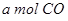 与
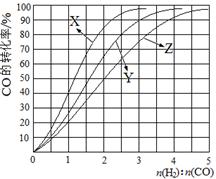
与 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: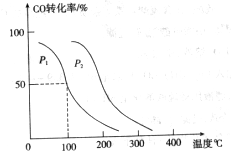

 (填“<”、“>”或“=”)
(填“<”、“>”或“=”) 、
、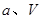 的代数式表示)。
的代数式表示)。 电极通入的
电极通入的 为 ,电极反应式是 。
为 ,电极反应式是 。
 溶液,当得到
溶液,当得到 铜时,参加反应的气体
铜时,参加反应的气体 的体积应为
的体积应为  (标准状况)。
(标准状况)。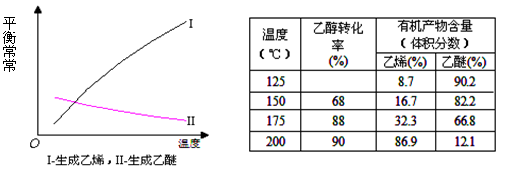
 H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题: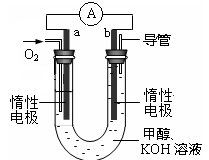

 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O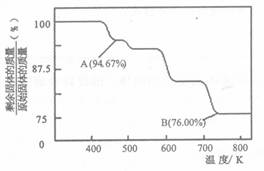
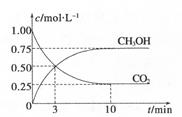
 CH3OH(g)+H2O(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。