ĢāÄæÄŚČŻ
£Ø10·Ö£©Ėę×ÅČĖĄą¶ŌĪĀŹŅŠ§Ó¦ŗĶ׏Ō“¶ĢȱµČĪŹĢāµÄÖŲŹÓ£¬ČēŗĪ½µµĶ“óĘųÖŠC02µÄŗ¬Įæ¼°ÓŠŠ§µŲæŖ·¢ĄūÓĆCO2£¬ŅżĘšĮĖø÷¹śµÄĘÕ±éÖŲŹÓ”£
(1)ĻĀĮŠ¹ŲÓŚC02µÄÓĆĶ¾²»ÕżČ·µÄŹĒ £ØĢīŠņŗÅ£©”£
E£®¶žŃõ»ÆĢ¼æÉŅŌ×÷ĪŖĘų·Ź£¬ĢįøßÅ©×÷ĪļµÄ²śĮæ
(2)ÄæĒ°¹¤ŅµÉĻÓŠŅ»ÖÖ·½·ØŹĒÓĆC02Ą“Éś²ś¼×“¼”£ĪŖĢ½¾æĘä·“Ó¦ŌĄķ£¬ĻÖ½ųŠŠČēĻĀŹµŃ飬ŌŚĢå»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬³äČė1 mol CO2ŗĶ3 mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) CH3OH(g)+H2O(g) ¦¤H=-49.0kJ£®m01-1£¬²āµĆC02ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
CH3OH(g)+H2O(g) ¦¤H=-49.0kJ£®m01-1£¬²āµĆC02ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
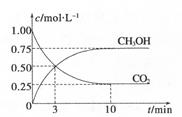
¢Ł“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬ĒāĘųµÄĘ½¾ł·“Ó¦ĖŁĀŹ£ŗv(H”£)= ”£
¢ŚøĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ ”£
(3)ŅŌKHC03ČÜŅŗĪŖµē½āÖŹ£¬ÓƵē½āµÄ·½·ØŅ²æÉŅŌ½«CO2»¹ŌĪŖ¼×“¼”£ĒėŠ“³öµē½āŹ±Ņõ¼«µÄĄė×Ó·½³ĢŹ½£ŗ
(4)½šøÕŹÆ”¢ŹÆÄ«Ļ©”¢ĻߊĶĢ¼ŹĒĢ¼µÄ¼øÖÖĶ¬ĖŲŅģŠĪĢ唣“Ó¼üµÄĄąŠĶ·ÖĪöĖüĆĒµÄĪČ¶ØŠŌÓÉĒæµ½ČõµÄĖ³ŠņĪŖ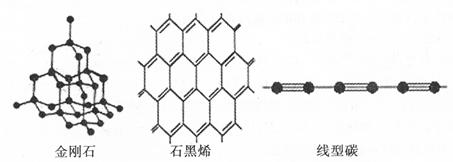
(1)ĻĀĮŠ¹ŲÓŚC02µÄÓĆĶ¾²»ÕżČ·µÄŹĒ £ØĢīŠņŗÅ£©”£
| A£®¶žŃõ»ÆĢ¼ÄÜČÜÓŚĖ®£¬æÉÓĆÓŚÉś²śĢ¼ĖįŠĶŅūĮĻ |
| B£®¹ĢĢ嶞Ńõ»ÆĢ¼Ė׳Ęøɱł£¬æÉÓĆÓŚČĖ¹¤½µÓź |
| C£®¶žŃõ»ÆĢ¼ÓĆÓŚĆš»šŹĒŅņĪŖ½µµĶĮĖæÉČ¼ĪļµÄ×Å»šµć |
| D£®³¬ĮŁ½ē¶žŃõ»ÆĢ¼×÷ŻĶČ”ČܼĮÓĆÓŚ“ÓĢģČ»²śĪļĢįČ”ŗĶ¾»»Æ»īŠŌ×é·Ö |
(2)ÄæĒ°¹¤ŅµÉĻÓŠŅ»ÖÖ·½·ØŹĒÓĆC02Ą“Éś²ś¼×“¼”£ĪŖĢ½¾æĘä·“Ó¦ŌĄķ£¬ĻÖ½ųŠŠČēĻĀŹµŃ飬ŌŚĢå»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬³äČė1 mol CO2ŗĶ3 mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ¦¤H=-49.0kJ£®m01-1£¬²āµĆC02ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
CH3OH(g)+H2O(g) ¦¤H=-49.0kJ£®m01-1£¬²āµĆC02ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
¢Ł“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬ĒāĘųµÄĘ½¾ł·“Ó¦ĖŁĀŹ£ŗv(H”£)= ”£
¢ŚøĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ ”£
(3)ŅŌKHC03ČÜŅŗĪŖµē½āÖŹ£¬ÓƵē½āµÄ·½·ØŅ²æÉŅŌ½«CO2»¹ŌĪŖ¼×“¼”£ĒėŠ“³öµē½āŹ±Ņõ¼«µÄĄė×Ó·½³ĢŹ½£ŗ
(4)½šøÕŹÆ”¢ŹÆÄ«Ļ©”¢ĻߊĶĢ¼ŹĒĢ¼µÄ¼øÖÖĶ¬ĖŲŅģŠĪĢ唣“Ó¼üµÄĄąŠĶ·ÖĪöĖüĆĒµÄĪČ¶ØŠŌÓÉĒæµ½ČõµÄĖ³ŠņĪŖ

£Ø10·Ö£©
£Ø1£©C £Ø2·Ö£©
£Ø2£©¢Ł0.225mol?L-1?min-1£Ø2·Ö£©”£¢Ś 5.33( mol?L-1)-2 £Øµ„Ī»²»×÷ŅŖĒó£¬2·Ö£©
£Ø3£©CO2+6HCO3-+6e-=CH3OH+6CO32-+H2O£Ø»ņCO2+5H2O+6e-=CH3OH+6OH -£©£Ø2·Ö£©
£Ø4£©ĻߊĶĢ¼>ŹÆÄ«Ļ©>½šøÕŹÆ£Ø2·Ö£©
£Ø1£©C £Ø2·Ö£©
£Ø2£©¢Ł0.225mol?L-1?min-1£Ø2·Ö£©”£¢Ś 5.33( mol?L-1)-2 £Øµ„Ī»²»×÷ŅŖĒó£¬2·Ö£©
£Ø3£©CO2+6HCO3-+6e-=CH3OH+6CO32-+H2O£Ø»ņCO2+5H2O+6e-=CH3OH+6OH -£©£Ø2·Ö£©
£Ø4£©ĻߊĶĢ¼>ŹÆÄ«Ļ©>½šøÕŹÆ£Ø2·Ö£©
(1)Č¼ÉյıŲŅŖĢõ¼žŹĒæÉČ¼Īļ“ļµ½×Å»šµćĒŅÓŠŃõĘų£¬¶žŃõ»ÆĢ¼ÓĆÓŚĆš»šÖ÷ŅŖŹĒ²ÉÓĆ½«æÉČ¼ĪļÓėŃõĘųøōĄėµÄ°ģ·Ø“ļµ½ÄæµÄ
£Ø2£©¢Łv(CO2)=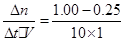 =0.075mol?L-1?min-1£¬ÓÉ·½³ĢŹ½µÄĻµŹż±ČæÉÖŖv(H2)=3v(CO2)=0.225mol?L-1?min-1
=0.075mol?L-1?min-1£¬ÓÉ·½³ĢŹ½µÄĻµŹż±ČæÉÖŖv(H2)=3v(CO2)=0.225mol?L-1?min-1
¢ŚŅĄ¾ŻĖłøųŹż¾Ż£¬Ę½ŗā³£ŹżK=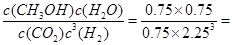 5.33( mol?L-1)-2
5.33( mol?L-1)-2
(3)ÓÉ»ÆŗĻ¼ŪµÄÉż½µæÉÖŖ£¬CO2ÖŠµÄĢ¼ŌŖĖŲÓė+4¼Ū½µµ½CH3OHÖŠĢ¼ŌŖĖŲµÄ”Ŗ2¼Ū£¬µĆµē×Ó£¬·¢ÉśĮĖ»¹Ō·“Ó¦£¬¹Ź£ŗCO2+6e- CH3OH£¬ČÜŅŗĪŖ¼īŠŌ»·¾³£¬ĪŖ“ļµ½µēŗÉŹŲŗć£¬ŌņCO2+6e-
CH3OH£¬ČÜŅŗĪŖ¼īŠŌ»·¾³£¬ĪŖ“ļµ½µēŗÉŹŲŗć£¬ŌņCO2+6e- CH3OH+6OH -£¬ŌŁøł¾ŻŌ×ÓŹŲŗćµĆ£ŗCO2+5H2O+6e-=CH3OH+6OH -£©
CH3OH+6OH -£¬ŌŁøł¾ŻŌ×ÓŹŲŗćµĆ£ŗCO2+5H2O+6e-=CH3OH+6OH -£©
£Ø4£©ĪļÖŹÄŚµÄ¼üµÄ¼üÄÜŌ½“ó£¬ŌņĪļÖŹŌ½ĪČ¶Ø£¬ÓÉÓŚ¼üÄÜĖ³ŠņĪŖ£ŗĢ¼Ģ¼Čž¼ü>Ģ¼Ģ¼Ė«¼ü>Ģ¼Ģ¼µ„¼ü£¬¹ŹĪČ¶ØŠŌÓÉĒæµ½ČõµÄĖ³ŠņĪŖ£ŗĻߊĶĢ¼>ŹÆÄ«Ļ©>½šøÕŹÆ
£Ø2£©¢Łv(CO2)=
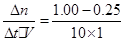 =0.075mol?L-1?min-1£¬ÓÉ·½³ĢŹ½µÄĻµŹż±ČæÉÖŖv(H2)=3v(CO2)=0.225mol?L-1?min-1
=0.075mol?L-1?min-1£¬ÓÉ·½³ĢŹ½µÄĻµŹż±ČæÉÖŖv(H2)=3v(CO2)=0.225mol?L-1?min-1¢ŚŅĄ¾ŻĖłøųŹż¾Ż£¬Ę½ŗā³£ŹżK=
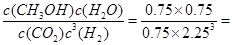 5.33( mol?L-1)-2
5.33( mol?L-1)-2(3)ÓÉ»ÆŗĻ¼ŪµÄÉż½µæÉÖŖ£¬CO2ÖŠµÄĢ¼ŌŖĖŲÓė+4¼Ū½µµ½CH3OHÖŠĢ¼ŌŖĖŲµÄ”Ŗ2¼Ū£¬µĆµē×Ó£¬·¢ÉśĮĖ»¹Ō·“Ó¦£¬¹Ź£ŗCO2+6e-
 CH3OH£¬ČÜŅŗĪŖ¼īŠŌ»·¾³£¬ĪŖ“ļµ½µēŗÉŹŲŗć£¬ŌņCO2+6e-
CH3OH£¬ČÜŅŗĪŖ¼īŠŌ»·¾³£¬ĪŖ“ļµ½µēŗÉŹŲŗć£¬ŌņCO2+6e- CH3OH+6OH -£¬ŌŁøł¾ŻŌ×ÓŹŲŗćµĆ£ŗCO2+5H2O+6e-=CH3OH+6OH -£©
CH3OH+6OH -£¬ŌŁøł¾ŻŌ×ÓŹŲŗćµĆ£ŗCO2+5H2O+6e-=CH3OH+6OH -£©£Ø4£©ĪļÖŹÄŚµÄ¼üµÄ¼üÄÜŌ½“ó£¬ŌņĪļÖŹŌ½ĪČ¶Ø£¬ÓÉÓŚ¼üÄÜĖ³ŠņĪŖ£ŗĢ¼Ģ¼Čž¼ü>Ģ¼Ģ¼Ė«¼ü>Ģ¼Ģ¼µ„¼ü£¬¹ŹĪČ¶ØŠŌÓÉĒæµ½ČõµÄĖ³ŠņĪŖ£ŗĻߊĶĢ¼>ŹÆÄ«Ļ©>½šøÕŹÆ

Į·Ļ°²įĻµĮŠ“š°ø
Ļą¹ŲĢāÄæ

 2NH3(g) ¦¤H <0”£400”ꏱ£¬K= 0.5£¬Ä³Ņ»Ź±æĢ²āµĆN2”¢H2ŗĶNH3ČżÖÖĪļÖŹĪļÖŹµÄĮæ·Ö±šĪŖ2mol”¢1molŗĶ3mol£¬ŌņøĆ·“Ó¦µÄvÕż(N2) vÄę£ØN2£©£ØĢī ”°>”± ”¢”°="”±" »ņ ”°<”±£©
2NH3(g) ¦¤H <0”£400”ꏱ£¬K= 0.5£¬Ä³Ņ»Ź±æĢ²āµĆN2”¢H2ŗĶNH3ČżÖÖĪļÖŹĪļÖŹµÄĮæ·Ö±šĪŖ2mol”¢1molŗĶ3mol£¬ŌņøĆ·“Ó¦µÄvÕż(N2) vÄę£ØN2£©£ØĢī ”°>”± ”¢”°="”±" »ņ ”°<”±£© ÅضČmol.L-1
ÅضČmol.L-1
 3C(g)+D(s)µÄÓ°Ļģ£¬ŅŅµÄŃ¹Ēæ“ó
3C(g)+D(s)µÄÓ°Ļģ£¬ŅŅµÄŃ¹Ēæ“ó


 CO2(g)+H2(g)”±ÖŠµÄ”÷H“óÓŚ0
CO2(g)+H2(g)”±ÖŠµÄ”÷H“óÓŚ0