题目内容
(10分)图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答:
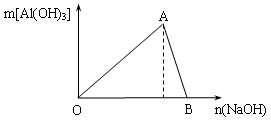
Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比_______;
Ⅱ.(B处溶液中存在的浓度最大的离子是_____________(填离子符号);
Ⅲ.(铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++AlO2-+H2O=Al(OH)3↓+NH3↑。
试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式: ;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少。请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
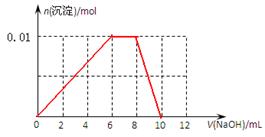
(3)向含有0.01mol NH4Al(SO4)2溶液中逐滴加入5mol·L-1NaOH溶液,请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比_______;
Ⅱ.(B处溶液中存在的浓度最大的离子是_____________(填离子符号);
Ⅲ.(铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++AlO2-+H2O=Al(OH)3↓+NH3↑。
试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式: ;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少。请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
(3)向含有0.01mol NH4Al(SO4)2溶液中逐滴加入5mol·L-1NaOH溶液,请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

(10分)Ⅰ 3(2分);Ⅱ Na+(2分);
Ⅲ(1)NH4Al(SO4)2=NH4++Al3++2SO42- (2分)(2)①③②⑤④ (2分)
(3)
(2分)
Ⅲ(1)NH4Al(SO4)2=NH4++Al3++2SO42- (2分)(2)①③②⑤④ (2分)
(3)

(2分)
试题分析:Ⅰ.根据反应式Al3++3OH-===Al(OH)3↓可知,A点时已参加反应的AlCl3和NaOH的物质的量之比为1:3。
Ⅱ.B处溶液中恰好生成偏铝酸钠,由于AlO2-水解,浓度降低,所以存在的浓度最大的离子是钠离子。
Ⅲ.(1)硫酸铝铵在水溶液中电离的方程式是NH4Al(SO4)2=NH4++Al3++2SO42-。
(2)根据溶液中的阳离子可知,在逐滴加入NaOH溶液的过程中,OH-首先和Al3+反应生成氢氧化铝白色沉淀。由于NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++AlO2-+H2O=Al(OH)3↓+NH3↑,所以当氢氧化铝不再发生变化时,OH-再和NH4+反应生成氨水。最后加入的氢氧化钠溶解氢氧化铝生成偏铝酸钠。所以正确的实验现象依次是①③②⑤④。
(3)根据(2)中分析可知,正确的图像是
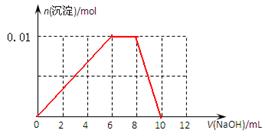
点评:该题综合性强,难度较大,试题贴近高考,灵活性强。该题再注重对基础知识考查和巩固的同时,更侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑思维能力和抽象思维能力,提高学生的规范答题能力和应试能力。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol
 H++OH-、HC2O4-
H++OH-、HC2O4-
 CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据: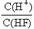 的值始终保持增大
的值始终保持增大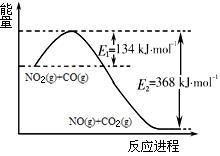
 2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表: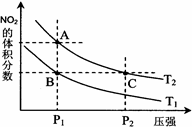
 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体
 2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”)
2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”) 浓度mol.L-1
浓度mol.L-1