题目内容
1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
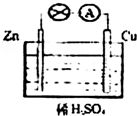
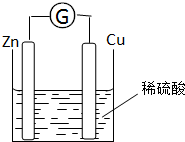
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a b相连,a为负极;c d相连,c为负极;a c相连,c为正极;b d相连,b为正极,则四种金属的活动性由强到弱顺序为:
(4)写出Na2CO3溶于水后的电离方程式: ________________________________________________________
(5)写出氯化铁溶液水解反应的离子方程式: ______________________________________________
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a b相连,a为负极;c d相连,c为负极;a c相连,c为正极;b d相连,b为正极,则四种金属的活动性由强到弱顺序为:
(4)写出Na2CO3溶于水后的电离方程式: ________________________________________________________
(5)写出氯化铁溶液水解反应的离子方程式: ______________________________________________
1)HX>HY>HZ (2)Al2O3 (3)a>c>d>b
(4)Na2CO3 =" 2" Na++ CO32- (5)Fe3+ + 3H2O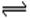 Fe (OH)3 + 3H+
Fe (OH)3 + 3H+
(4)Na2CO3 =" 2" Na++ CO32- (5)Fe3+ + 3H2O
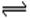 Fe (OH)3 + 3H+
Fe (OH)3 + 3H+ 略

练习册系列答案
相关题目

 2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”)
2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”) 浓度mol.L-1
浓度mol.L-1

 N2+2CO2。
N2+2CO2。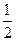 O2(g)=2CO2(g) △H=一283 kJ/mol
O2(g)=2CO2(g) △H=一283 kJ/mol 出行
出行

 CO2(g)+H2(g)”中的△H大于0
CO2(g)+H2(g)”中的△H大于0