题目内容
(16分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g)≒CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
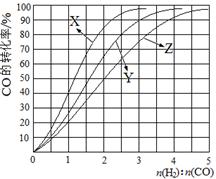
230℃的实验结果所对应的曲线是 (填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是 (填字母)。A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减 小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
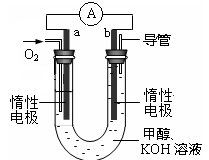
①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池负极反应式为 ,电池总反应的离子方程式为 。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g)≒CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。

|
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g)
 H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:①该温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减 小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。

①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池负极反应式为 ,电池总反应的离子方程式为 。
(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H =-443.5kJ·mol-1
(2)X ; B (3)① > ② 增大
(4)① b ② CH3OH - 6e-+ 8OH-=CO32- + 6H2O
2CH3OH + 3O2 + 4OH-=2CO32- + 6H2O
(2)X ; B (3)① > ② 增大
(4)① b ② CH3OH - 6e-+ 8OH-=CO32- + 6H2O
2CH3OH + 3O2 + 4OH-=2CO32- + 6H2O
(1)考查盖斯定律的应用。根据反应①CO(g)+1/2O2(g)=CO2(g)和反应②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)可知,②-①×2即得到2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l),所以反应热是-1453.0kJ/mol+283.0 kJ/mol×2=-887 kJ/mol。
(2)因为反应是放热反应,所以温度越高,转化率越低。因此根据图像可判断曲线X表示的是230℃。同样根据图像可判断,n(H2):n(CO) 的比值范围在2.5~3时,转化率最高,所以答案选B。
(3)①根据方程式可知当氢气浓度是0.5mol/L时,生成物CO2的浓度也是0.5mol/L。消耗水蒸气和CO的浓度都是0.5mol/L,则剩余水蒸气和CO的浓度分别是0.5mol/L和1.5mol/L。此时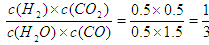 <1,所以反应向正反应方向移动,即正反应速率大于逆反应速率。
<1,所以反应向正反应方向移动,即正反应速率大于逆反应速率。
②正反应是放热反应,降低温度,平衡向正反应方向移动,平衡常数增大。
(4)原电池中负极失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。在该燃料电池中,正极通入氧气,负极通入甲醇,所以a是正极,b是负极。电解质是碱性溶液,所以负极电极反应式为CH3OH - 6e-+ 8OH-=CO32- + 6H2O,电池总反应式为2CH3OH + 3O2 + 4OH-=2CO32- + 6H2O。
(2)因为反应是放热反应,所以温度越高,转化率越低。因此根据图像可判断曲线X表示的是230℃。同样根据图像可判断,n(H2):n(CO) 的比值范围在2.5~3时,转化率最高,所以答案选B。
(3)①根据方程式可知当氢气浓度是0.5mol/L时,生成物CO2的浓度也是0.5mol/L。消耗水蒸气和CO的浓度都是0.5mol/L,则剩余水蒸气和CO的浓度分别是0.5mol/L和1.5mol/L。此时
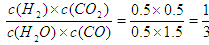 <1,所以反应向正反应方向移动,即正反应速率大于逆反应速率。
<1,所以反应向正反应方向移动,即正反应速率大于逆反应速率。②正反应是放热反应,降低温度,平衡向正反应方向移动,平衡常数增大。
(4)原电池中负极失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。在该燃料电池中,正极通入氧气,负极通入甲醇,所以a是正极,b是负极。电解质是碱性溶液,所以负极电极反应式为CH3OH - 6e-+ 8OH-=CO32- + 6H2O,电池总反应式为2CH3OH + 3O2 + 4OH-=2CO32- + 6H2O。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
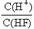 的值始终保持增大
的值始终保持增大 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0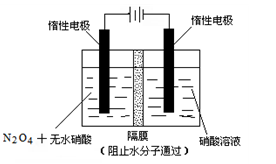
 CO(g)
CO(g) CH3OH(g)
CH3OH(g) kJ;
kJ;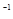 )
)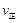 (甲醇)
(甲醇) 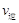 (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。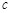 (CH3OH)
(CH3OH) (CH3OH)
(CH3OH)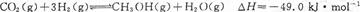

 2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”)
2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”) 浓度mol.L-1
浓度mol.L-1 Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。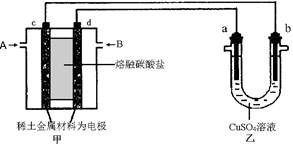
 N2+2CO2。
N2+2CO2。 O2(g)=2CO2(g) △H=一283 kJ/mol
O2(g)=2CO2(g) △H=一283 kJ/mol 出行
出行