题目内容
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Kb=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分別加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是( )
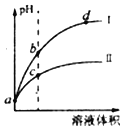
A. 曲线Ⅰ为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C. b点溶液中水的电离程度比c点溶液中水的电离程度小
D. 从b点到d点,溶液中![]() 保持不变(HR代表HClO或HF)
保持不变(HR代表HClO或HF)
【答案】D
【解析】pH相同的弱酸溶液加水稀释,其pH应该都会升高,其中酸性越强,其pH的变化应该越明显(或者说曲线的斜率应该越大),因为Kb>Ka,所以HF的酸性更强,所以曲线Ⅰ为氢氟酸稀释时pH变化曲线,选项A错误。中和相同体积、相同浓度的NaOH溶液,消耗的次氯酸和氢氟酸的物质的量一定相等,a点两者的pH相同,因为HF酸性更强,所以HF的溶度较小,达到相同的物质的量需要较大的体积,所以消耗的氢氟酸的体积较大,选项B错误。c点比b点的pH更小,说明c点酸电离出来的氢离子浓度更大,所以对于水的电离的抑制应该更强,水的电离程度应该是c点更小,选项C错误。![]() 可以认为是R-的水解平衡常数,该数值应该只与温度有关,所以选项D正确。
可以认为是R-的水解平衡常数,该数值应该只与温度有关,所以选项D正确。

练习册系列答案
相关题目
【题目】在相同温度和压强下,对反应X(g)+Y(g)![]() Z(g)+W(g)进行四组实验,实验起始时放入容器内各组分的物质的量见表:
Z(g)+W(g)进行四组实验,实验起始时放入容器内各组分的物质的量见表:
实验 | X | Y | Z | W |
① | amol | amol | 0mol | 0mol |
② | 3amol | amol | 0mol | 0mol |
③ | 0mol | 0mol | amol | amol |
④ | 2amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(Z)的大小顺序是( )
A. ②=④>①=③B. ②>④>①>③
C. ④>②>①=③D. ④>③>②>①