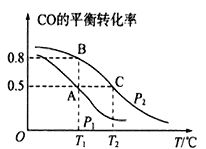
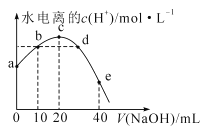
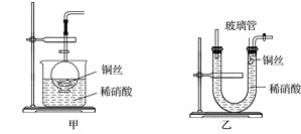
题目内容
【题目】取7.90g KMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素只以Mn2+存在。下列说法中错误的是( )
A.反应过程中生成氧气的物质的量是0.015mol
B.气体A是氯气,它的物质的量是0.095mol
C.KMnO4的分解率是60%
D.整个反应过程中转移了0.19mole-
【答案】D
【解析】
根据2KMnO4![]() K2MnO4+MnO2+O2↑,n(O2)=
K2MnO4+MnO2+O2↑,n(O2)=![]() =0.015mol,则分解的高锰酸钾n(KMnO4)= 2n(O2)=0.03mol; 7.90g KMnO4物质的量为
=0.015mol,则分解的高锰酸钾n(KMnO4)= 2n(O2)=0.03mol; 7.90g KMnO4物质的量为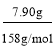 =0.05mol,若7.90g KMnO4不分解完全与浓盐酸完全反应,由方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O分析知转移的电子为0.05mol×5=0. 25mol,分解高锰酸钾放出O2而转移的电子:0.015mol×4=0.06mol,因此实际生成单质气体Cl2转移的电子为0.25mol—0.06mol=0.19mol,生成的Cl2的n(Cl2)=
=0.05mol,若7.90g KMnO4不分解完全与浓盐酸完全反应,由方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O分析知转移的电子为0.05mol×5=0. 25mol,分解高锰酸钾放出O2而转移的电子:0.015mol×4=0.06mol,因此实际生成单质气体Cl2转移的电子为0.25mol—0.06mol=0.19mol,生成的Cl2的n(Cl2)= ![]() =0.095mol。
=0.095mol。
A.根据2KMnO4![]() K2MnO4+MnO2+O2↑,n(O2)=
K2MnO4+MnO2+O2↑,n(O2)=![]() =0.015mol,A项正确;
=0.015mol,A项正确;
B.若7.90g KMnO4与浓盐酸完全反应,由方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O分析知n(e—)=0.05mol×5=0. 25mol,分解高锰酸钾放出O2而转移的电子为0.015mol×4=0.06mol,因此生成单质气体Cl2转移的电子为0.25mol—0.06mol=0.19mol,生成的Cl2的n(Cl2)= ![]() =0.095mol,B项正确;
=0.095mol,B项正确;
C.n(KMnO4)=2n(O2)=0.03mol,则KMnO4的分解率: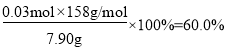 , C项正确;
, C项正确;
D.由B选项计算结果知整个过程转移电子n(e—)=0.05mol×5=0.25mol,生成单质气体Cl2转移的电子为0.25mol—0.06mol=0.19mol,D项错误;
答案选D。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大