��Ŀ����
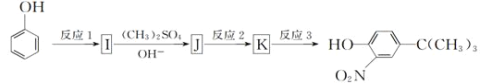
����Ŀ���Զ�����(CH3OCH3)����ȼ�ϵ��Ϊ��Դ����ⱥ��ʳ��ˮ�Ʊ��������ռ���װ����ͼ��ʾ����֪��a��Q�ķ�ӦʽΪO2+4H++4e-=2H2O������˵������ȷ���ǣ� ��

A.b�缫�ķ�ӦʽΪCH3OCH3+3H2O-12e-=2CO2��+12H+
B.�Լ�AΪ����ʳ��ˮ���Լ�BΪNaOHϡ��Һ
C.��������1mol����ʱ�������ϵ���������2mole-
D.��������1mol����ʱ����1mol����ͨ�����ӽ���Ĥ
���𰸡�D
��������
a��Q�ķ�ӦʽΪO2+4H��+4e���T2H2O����a�缫Ϊ���������Ե缫b�Ǹ�������������Ӧ���缫��ӦʽΪ��CH3OCH3-12e��+3H2O�T2CO2+12H������a�缫������M�缫Ϊ����ʧ���ӷ���������Ӧ�������Լ�AΪ����ʳ��ˮ����ӦʽΪ2Cl��-2e���TCl2������b�缫������N�缫Ϊ�����õ��ӷ�����ԭ��Ӧ�������Լ�BΪNaOHϡ��Һ����ӦʽΪ2H��+2e���TH2����
A��a��Q�ķ�ӦʽΪO2+4H��+4e���T2H2O����a�缫Ϊ���������Ե缫b�Ǹ�������������Ӧ���缫��ӦʽΪ��CH3OCH3-12e��+3H2O�T2CO2+12H������A��ȷ��
B���������Ϸ������Լ�AΪ����ʳ��ˮ���Լ�BΪNaOHϡ��Һ����B��ȷ��
C����b�缫������N�缫Ϊ�����õ��ӷ�����ԭ��Ӧ�������Լ�BΪNaOHϡ��Һ����ӦʽΪ2H��+2e���TH2����������������1 mol����ʱ�������ϵ���������2 mol e������C��ȷ��
D��M�缫Ϊ����ʧ���ӷ���������Ӧ�������Լ�AΪ����ʳ��ˮ����ӦʽΪ2Cl��-2e���TCl2����������1 mol����ʱ����2mol����ͨ�����ӽ���Ĥ����D����
��ѡD��

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�����Ŀ����������1mol��ѧ�������γ���̬ԭ������Ҫ��������![]() ��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
���ۼ� | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
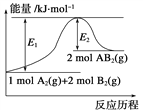
A. 432kJ/mol>E(H-Br)>298kJ/mol B. �������ȶ��Ĺ��ۼ���H-F��
C. H2(g)��2H(g) ��H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) ��H=-25kJ/mol