题目内容
【题目】草酸(H2C2O4,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用,常温下,H2C2O4:Ka1=5.4×10-2,Ka2=5.4×10-5。H2CO3:K1=4×10-7K2=6×10-11。
(1)NaHCO3溶液显____性。
(2)常温下,0.1mol·L-1的Na2C2O4溶液pH=a,0.1 mol·L-1的Na2CO3溶液pH=b,则a___b(填“>”“<”或“=”)。
(3)常温下,pH=3的H2C2O4溶液的物质的量浓度为c1,水电离出的c(H+)为c3;pH=4的H2C2O4溶液的物质的量浓度为c2,水电离出的c(H+)为c4。则c1_____10c2(填“>”“<”或“=”,下同);c3___10c4。
(4)常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)
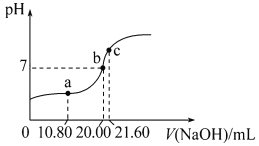
①该草酸溶液的物质的量浓度为_________(结果保留三位小数)。
②a点所示溶液中各离子的浓度由大到小的顺序为__________。
【答案】碱 < > = 0.054mol·L-1 c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
【解析】
(1)根据盐的组成判断;
(2)根据弱酸的电离平衡常数,结合盐的水解规律分析判断;
(3)弱酸在溶液中存在电离平衡,稀释促使弱酸的电离;
(4)①根据微粒浓度关系可知:在c点时溶液为Na2C2O4,根据元素守恒判断酸的浓度,
②a点所示溶液显示酸性,此时草酸未完全中和,得到的是草酸氢钠溶液,根据盐电离程度及盐的水解规律回答。
(1)NaHCO3是强碱弱酸盐,HCO3-会发生水解反应,消耗水电离产生的H+产生H2CO3,当最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性;
(2)H2C2O4、H2CO3都是二元弱酸,由于电离平衡常数Ka2(H2C2O4)>Ka2(H2CO3),所以盐的水解程度:Na2C2O4< Na2CO3,这两种盐都是强碱弱酸盐,根据盐水解规律:谁弱谁水解,越弱越水解,谁强显谁性,可知盐溶液的碱性:Na2C2O4< Na2CO3,所以溶液的pH:a<b;
(3)常温下,pH=3的H2C2O4溶液的物质的量浓度为c1=10-3mol/L,水电离出的c(H+)为c3=c(OH-)=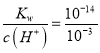 =10-11;pH=4的H2C2O4溶液的物质的量浓度为c2,水电离出的c(H+)为c4=c(OH-)=
=10-11;pH=4的H2C2O4溶液的物质的量浓度为c2,水电离出的c(H+)为c4=c(OH-)=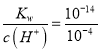 =10-10;由于草酸是二元弱酸,在溶液中存在酸的电离平衡,稀释促使酸的电离平衡正向移动,使酸的电离程度大于浓溶液,因此c1>10c2,c3=10c4。
=10-10;由于草酸是二元弱酸,在溶液中存在酸的电离平衡,稀释促使酸的电离平衡正向移动,使酸的电离程度大于浓溶液,因此c1>10c2,c3=10c4。
(4)①用0.100mol/L NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,根据 c点离子浓度之间的关系,得到c点的溶液是草酸钠的水溶液,草酸和氢氧化钠之间按照1:2物质的量之比进行反应,所以该草酸溶液的物质的量浓度c(H2C2O4)=![]() =0.54mol/L;②a点所示溶液显示酸性,草酸的电离平衡常数Ka1=5.4×10-2,HC2O4-的水解平衡常数Kh=
=0.54mol/L;②a点所示溶液显示酸性,草酸的电离平衡常数Ka1=5.4×10-2,HC2O4-的水解平衡常数Kh=![]() =1.85×10-13< Ka1=5.4×10-2,所以得到的是草酸氢钠溶液,由于电离大于水解,所以c(H+)>c(OH-),溶液中H+除了HC2O4-电离产生外,还有水的电离,而C2O42-只有HC2O4-电离产生,HC2O4-电离程度大于水的电离程度,所以c(H+)>c(C2O42-)> c(OH-),盐NaHC2O4是强电解质,完全电离,电离产生的离子浓度大于弱电解质的电离程度,HC2O4-电离、水解会消耗,则c(Na+)>c(HC2O4-),因此溶液中各离子的浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
=1.85×10-13< Ka1=5.4×10-2,所以得到的是草酸氢钠溶液,由于电离大于水解,所以c(H+)>c(OH-),溶液中H+除了HC2O4-电离产生外,还有水的电离,而C2O42-只有HC2O4-电离产生,HC2O4-电离程度大于水的电离程度,所以c(H+)>c(C2O42-)> c(OH-),盐NaHC2O4是强电解质,完全电离,电离产生的离子浓度大于弱电解质的电离程度,HC2O4-电离、水解会消耗,则c(Na+)>c(HC2O4-),因此溶液中各离子的浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。

【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol