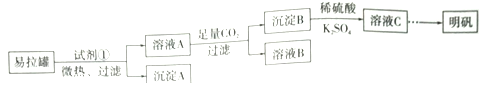
题目内容
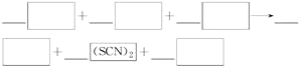
【题目】已知硫氰(SCN)2为拟卤素,其分子及阴离子的性质与卤素性质相似。完成下列填空:将硫氰化钾溶液与氯化铁溶液混合,溶液变为红色。
(1)写出该反应的化学方程式:________________________________。
(2)将生成的红色溶液分为三等份,进行如下实验(第三份是对照):
①第一份中滴加碘化钾溶液至过量,再加入四氯化碳,充分振荡,最终水层接近无色,四氯化碳层呈__________色,写出该过程的离子方程式:________________________。向该溶液中滴加少量溴水,水溶液又变为红色,则氧化性Br2________(填“大于”“小于”或“无法确定”) (SCN)2。
②第二份中加入少量酸性高锰酸钾溶液,血红色褪去。完成并配平该反应的离子方程式_________________。若含________mol高锰酸钾的溶液完全反应,转移电子2 mol。
【答案】FeCl3+3KSCN=Fe(SCN)3+3KCl 紫 2Fe3++2I-= 2Fe2++I2 无法确定 2MnO4-+10SCN-+16H+=2Mn2++5(SCN)2+8H2O 0.4
【解析】
(1)硫氰化钾溶液与氯化铁溶液反应生成Fe(SCN)3;
(2)①三价铁离子能将碘离子氧化为碘单质;溴单质氧化性大于二价铁离子,据此分析解答;②反应物是高锰酸根、氢离子和硫氰根,生成物是锰离子和(SCN)2;根据方程式中转移的电子数计算反应的高锰酸钾。
(1)硫氰化钾溶液与氯化铁溶液反应生成Fe(SCN)3,反应的化学方程式FeCl3+3KSCNFe(SCN)3+3KCl,故答案为:FeCl3+3KSCNFe(SCN)3+3KCl;
(2)①三价铁离子能将碘离子氧化为碘单质,四氯化碳能萃取碘水中的碘,四氯化碳层呈紫色,该过程的离子方程式2Fe3++2I-=2Fe2++I2;溴单质氧化性大于二价铁离子,能将二价铁离子氧化为三价铁离子,无法确定溴单质和(SCN)2的氧化性强弱,故答案为:紫;2Fe3++2I-=2Fe2++I2;无法确定;
②第二份中加入少量酸性高锰酸钾溶液,血红色褪去,说明高锰酸钾将SCN-氧化了,反应的离子方程式2MnO4-+10SCN-+16H+=2Mn2++5(SCN)2+8H2O,反应中转移了10个电子,故转移电子2mol,有0.4mol高锰酸钾溶液参加反应,故答案为:2MnO4-+10SCN-+16H+=2Mn2++5(SCN)2+8H2O;0.4。