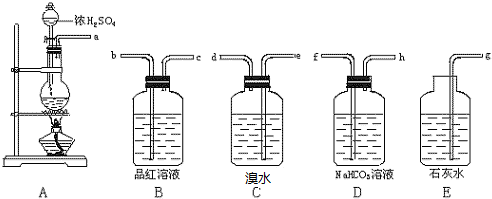
题目内容
20.已知下列热化学反应方程式( )①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8 kJ/mol
②Fe2O3(s)+$\frac{1}{3}$CO(g)=$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.4 kJ/mol
则1molCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
| A. | -218 kJ/mol | B. | -109 kJ/mol | C. | +218 kJ/mol | D. | +109 kJ/mol |
分析 依据盖斯定律结合热化学方程式$\frac{①×3-②×3-③×2}{6}$计算得到CO气体还原足量FeO固体的热化学方程式,从而得出反应热.
解答 解:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②Fe2O3(s)+$\frac{1}{3}$CO(g)=$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73 kJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ/mol
依据盖斯定律计算$\frac{①×3-②×3-③×2}{6}$,得到:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol,
则1mol CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的△H约为-218kJ/mol,
故选A.
点评 本题考查了热化学方程式书写方法,盖斯定律的计算应用,题目较简单.

练习册系列答案
相关题目
10.02、03、04、08年的诺贝尔化学奖均授予与蛋白质有关的研究成果,美籍华裔科学家钱永健是08年诺贝尔化学奖的获得者之一.下列关于蛋白质的说法中不正确的是( )
| A. | 蛋白质可与茚三酮作用,显示特征颜色 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 某些蛋白质跟浓硝酸作用会变黄 | |
| D. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 |
11.下列变化中,不需破坏化学键的是( )
| A. | 加热氯化铵 | B. | 干冰气化 | C. | 食盐熔化 | D. | 氯化氢溶于水 |
8.X、Y、Z、M、W五种短周期元素.X的质子总数与电子层数相同,Y、Z、M、W在周期表中的相对位置如表所示,且W原子核外电子数是M原子最外层电子数的2倍.
(1)五种元素原子半径从大到小排列为Si>N>O>F>H (均以元素符号表示,以下小题相同)
(2)写出W在周期表中的位置第三周期、IVA族,画出Z的离子结构示意图 .
.
(3)X、Y、Z 三种元素形成的化合物中属于离子化合物的物质的化学式是NH4NO3(或NH4NO2)
(4)W分别与M、Z元素形成的化合物WM4、WZ2分别属于分子 晶体、原子晶体,写出其中沸点较低的物质的电子式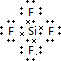
(5)X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的物质的结构式是H-F,稳定性最弱的物质的空间构型是正四面体,
(6)画出Y单质的电子式 .
.
(7)X的单质与Z的单质在KOH的溶液中可以形成原电池,已知A、B均为碳电极,在电池的A极通入X的单质气体,B极通入Z的单质气体,则B极的电极反应式为O2+2H2O+4e-=4OH-.
| Y | Z | M | |
| W |
(2)写出W在周期表中的位置第三周期、IVA族,画出Z的离子结构示意图
 .
.(3)X、Y、Z 三种元素形成的化合物中属于离子化合物的物质的化学式是NH4NO3(或NH4NO2)
(4)W分别与M、Z元素形成的化合物WM4、WZ2分别属于分子 晶体、原子晶体,写出其中沸点较低的物质的电子式

(5)X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的物质的结构式是H-F,稳定性最弱的物质的空间构型是正四面体,
(6)画出Y单质的电子式
 .
.(7)X的单质与Z的单质在KOH的溶液中可以形成原电池,已知A、B均为碳电极,在电池的A极通入X的单质气体,B极通入Z的单质气体,则B极的电极反应式为O2+2H2O+4e-=4OH-.
15.由短周期元素形成的化合物有许多组成情况如果化学式为XY2,下列叙述正确的( )
| A. | 如果XY2是共价化合物,则X与Y的原子序数不可能相差1 | |
| B. | 如果X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 | |
| C. | 如果X与Y的原子序数相差5,则离子化合物XY2不溶于水 | |
| D. | 如果XY2是离子化合物,则X与Y的原子序数可能相差9 |
12.下列化学用语的书写,正确的是( )
| A. | 氯原子的结构示意图: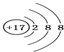 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式: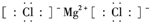 | |
| D. | 用电子式表示氯化氢的形成过程: |
9.质量比为2:3的铝分别与足量的盐酸和足量的氢氧化钠溶液反应,放出氢气在相同条件下的体积比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |