题目内容
12.下列化学用语的书写,正确的是( )| A. | 氯原子的结构示意图: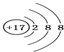 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式: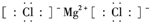 | |
| D. | 用电子式表示氯化氢的形成过程: |
分析 A.氯原子的核电荷数、核外电子数都是17,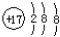 为氯离子结构示意图;
为氯离子结构示意图;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.氯化镁为离子化合物,其电子式需要标出离子所带电荷,氯离子需要标出最外层核外电子数;
D.氯化氢分子不存在阴阳离子,氯化氢的电子式不能标出所带电荷.
解答 解:A.氯离子的核外电子数为17,氯原子的结构示意图为: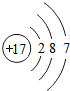 ,故A错误;
,故A错误;
B.6个质子8个中子的碳原子的质量数为14,该碳元素的核素符号为:614C,故B错误;
C.氯化镁中存在阴阳离子,氯化镁的电子式为: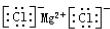 ,故C正确;
,故C正确;
D.氯化氢为共价化合物,氯化氢分子中不存在阴阳离子,用氯化氢的形成过程为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了原子结构示意图、电子式、结构简式等知识,题目难度中等,注意掌握离子化合物与共价化合物的电子式区别,明确电子式、分子式、结构简式、结构式的正确表示方法.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
20.已知下列热化学反应方程式( )
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8 kJ/mol
②Fe2O3(s)+$\frac{1}{3}$CO(g)=$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.4 kJ/mol
则1molCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8 kJ/mol
②Fe2O3(s)+$\frac{1}{3}$CO(g)=$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.4 kJ/mol
则1molCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
| A. | -218 kJ/mol | B. | -109 kJ/mol | C. | +218 kJ/mol | D. | +109 kJ/mol |
17.苯分子实际上不具有碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实有( )
①苯的间位二元取代物只有一种 ②苯的邻位二元取代物只有一种 ③苯不能使酸性KMnO4溶液褪色 ④苯能在一定条件下与氢气反应生成环己烷 ⑤苯在FeBr3存在的条件下同液溴发生取代反应.
①苯的间位二元取代物只有一种 ②苯的邻位二元取代物只有一种 ③苯不能使酸性KMnO4溶液褪色 ④苯能在一定条件下与氢气反应生成环己烷 ⑤苯在FeBr3存在的条件下同液溴发生取代反应.
| A. | ①③④ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
4.实验室配制一定物质的量浓度溶液时,下列仪器必不可少的是( )
| A. | 容量瓶 | B. | 试管 | C. | 烧瓶 | D. | 量筒 |
1.某化学兴趣小组为了探索铁电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
根据上表中的实验现象回答下列问题:
(1)实验1溶液中氯离子向Mg(填“Mg”或“Fe”)极移动;
(2)实验2中Fe为负(填“正”或“负”)极;
Cu电极反应式Cu2++2e-=Cu;
电池总反应Fe+Cu2+=Fe2++Cu;
(3)实验3中电流计指针偏向石墨方向.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Fe | 稀盐酸 | 偏向Fe |
| 2 | Fe、Cu | CuSO4溶液 | 偏向Cu |
| 3 | Fe、石墨 | 稀盐酸 | ? |
(1)实验1溶液中氯离子向Mg(填“Mg”或“Fe”)极移动;
(2)实验2中Fe为负(填“正”或“负”)极;
Cu电极反应式Cu2++2e-=Cu;
电池总反应Fe+Cu2+=Fe2++Cu;
(3)实验3中电流计指针偏向石墨方向.
15.下列关于化学键的说法正确的是( )
| A. | 化学键的类型由元素的类别决定 | |
| B. | 不同种元素组成的多原子分子里的化学键一定是极性键 | |
| C. | 阴、阳离子相互反应形成的化学键称为离子键 | |
| D. | 熔融态下能导电的化合物中一定含离子键 |


 .
. ,
, .
. ,分子构型三角锥形.用电离方程式表示其水溶液呈碱性的原因NH3+H2O
,分子构型三角锥形.用电离方程式表示其水溶液呈碱性的原因NH3+H2O NH3•H2O
NH3•H2O