��Ŀ����
����Ŀ��CO2��һ�ֳ������������壬�������պ�����Ҳ��Ϊ�ִ��Ƽ������ſ��⡣
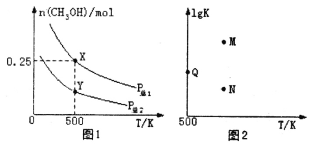
(1)�����ܱ������У���Cu/ZnO���������£�����CO2�Ʊ��״���CO2(g) + 3H2(g)CH3OH(g) + H2O(l) ��H1����֪�� CH3OH(g) +![]() O2(g)=CO2(g) + 2H2O(l) ��H2��д������ȼ���ȵ��Ȼ�ѧ����ʽ________(��H�á�H1�� ��H2��ʾ)��ij�¶��£������Ϊ2L���ܱ������м���2mol CO2��5mol H2�Լ��������з�Ӧ����CH3OH ������ˮ�������ﵽƽ��ʱH2��ת������60%����ƽ�ⳣ��Ϊ_______��
O2(g)=CO2(g) + 2H2O(l) ��H2��д������ȼ���ȵ��Ȼ�ѧ����ʽ________(��H�á�H1�� ��H2��ʾ)��ij�¶��£������Ϊ2L���ܱ������м���2mol CO2��5mol H2�Լ��������з�Ӧ����CH3OH ������ˮ�������ﵽƽ��ʱH2��ת������60%����ƽ�ⳣ��Ϊ_______��
(2)��ҵ����CO2��������ȡ�����ѣ�2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)����������ͬ�ĺ����ܱ������У���������ķ�Ӧ��ֱ���Ir��Ce����������Ӧ������ͬ��ʱ����õ�CO2��ת������(CO2)�淴Ӧ�¶ȵı仯�����ͼ��ʾ��
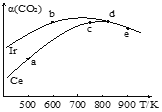
����Ir��Ce������ʱ����Ӧ�Ļ�ܸ��͵���_________��
��a��b��c��d��e����״̬����Ӧһ���ﵽƽ��״̬����________����Ӧ����H ____0(���������=������)��
�۴�״̬a��c��CO2ת���ʲ��������ԭ����__________��
����֪T���£���2 molCO2��6 molH2ͨ�뵽���ΪV L���ܱ������н���������Ӧ����Ӧʱ���������ڵ���ѹǿ���������
ʱ��t/min | 0 | 10 | 20 | 30 | 40 |
��ѹǿp/1000kPa | 1.0 | 0.83 | 0.68 | 0.60 | 0.60 |
�÷�Ӧƽ��ʱCO2��ת����Ϊ___________��
(3)��ҵ�ϳ��ð�ˮ���պ�̼ȼ��ȼ���в�������������CO2���õ�NH4HCO3��Һ����ӦNH4++HCO3��+H2ONH3��H2O+H2CO3��ƽ�ⳣ��K=_________��(��֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10��5��H2CO3�ĵ���ƽ�ⳣ��Ka1=4��10��7��Ka2=4��10��11 )��
���𰸡�H2 (g) +![]() O2 (g)=H2O(l) ��H=(��H1+ ��H2)/3 0.5 Ir d��e �� ״̬a��c��δ�ﵽƽ�⣬״̬c�¶ȸ߷�Ӧ���ʿ죬CO2��ת������ת���ʸ� 80% 1.25��10��3
O2 (g)=H2O(l) ��H=(��H1+ ��H2)/3 0.5 Ir d��e �� ״̬a��c��δ�ﵽƽ�⣬״̬c�¶ȸ߷�Ӧ���ʿ죬CO2��ת������ת���ʸ� 80% 1.25��10��3
��������
(1)��֪��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ��H1����CH3OH(g)+
CH3OH(g)+H2O(l) ��H1����CH3OH(g)+![]() O2(g)
O2(g)![]() CO2(g)+2H2O(l) ��H2���ɸ�˹���ɼ���(��+��)��
CO2(g)+2H2O(l) ��H2���ɸ�˹���ɼ���(��+��)��![]() �õ�����ȼ���ȵ��Ȼ�ѧ����ʽ��H2(g)+
�õ�����ȼ���ȵ��Ȼ�ѧ����ʽ��H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ��H=
H2O(l) ��H=![]() (��H1+��H2)��ij�¶��£������Ϊ2L���ܱ������м���2mol CO2��5molH2�Լ��������з�Ӧ����CH3OH������ˮ�������ﵽƽ��ʱH2��ת������60%�������������ʵ���Ũ��=2.5mol/L��60%=1.5mol/L��������ʽ�У�
(��H1+��H2)��ij�¶��£������Ϊ2L���ܱ������м���2mol CO2��5molH2�Լ��������з�Ӧ����CH3OH������ˮ�������ﵽƽ��ʱH2��ת������60%�������������ʵ���Ũ��=2.5mol/L��60%=1.5mol/L��������ʽ�У�
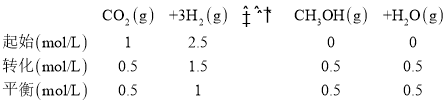
��ƽ�ⳣ��![]() ���ʴ�Ϊ��H2(g)+
���ʴ�Ϊ��H2(g)+![]() O2(g)
O2(g)![]() H2O(l)
H2O(l) ![]() (��H1+��H2)��0.5��
(��H1+��H2)��0.5��
(2)�ٸ���ͼʾ��Ϣ���ֱ���Ir��Ce����������Ӧ������ͬ��ʱ����õ�CO2��ת����a(CO2)�淴Ӧ�¶ȵı仯������õ���CO2��ת����a(CO2)�ߣ�������Ч�ʸߣ���ܽ�С��������Ir��Ce������ʱ����Ӧ�Ļ�ܸ��͵���Ir���ʴ�Ϊ��Ir��������Ӱ��ת���ʣ�a��b��c��d��e����״̬����Ӧ�ﵽƽ��״̬ʱ��CO2��ת����a(CO2)���ٱ仯����ƽ��״̬��d��e���ﵽƽ���Ժ��¶����ߣ�CO2��ת����a(CO2)��С������ƽ�������ƶ�����Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ���ʱ�С���㣬�ʴ�Ϊ��d��e������
��״̬a��c��δ�ﵽƽ�⣬״̬c�¶ȸ߷�Ӧ���ʿ죬CO2��ת������ת���ʸߣ��ʴ�Ϊ��״̬a��c
��T���£���2molCO2��6molH2ͨ�뵽���ΪVL���ܱ������н���������Ӧ��ͼ�����ݿ�֪��ƽ��״̬����ѹǿ����0.4KPa�������ɶ��������ʵ���Ϊx mol��������ʽ�У�
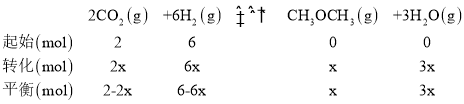
���ݰ����ӵ�����PV=nRT������ѹǿ֮�ȵ����������ʵ���֮�ȣ���![]() ����x=0.8��ƽ��ʱCO2��ת����
����x=0.8��ƽ��ʱCO2��ת����![]() ���ʴ�Ϊ��80%��
���ʴ�Ϊ��80%��
(3)��ӦNH4++HCO3��+H2ONH3��H2O+H2CO3��ƽ�ⳣ�� ���ʴ�Ϊ��1.25��10��3��
���ʴ�Ϊ��1.25��10��3��

����Ŀ����֪��������ʵ����ܷ�����ѧ��Ӧ��
�� | �� | �� |
��������������ͭ��Һ�� | ������������Һ�е��뼸����ˮ | ��ͭ˿�����Ȼ�����Һ�� |
�����ж���ȷ����
A.ʵ�����������ԭ��B.ʵ�����![]() �������������Ի�ԭ��
�������������Ի�ԭ��
C.ʵ����з��������û���ӦD.����ʵ��֤��������:![]()