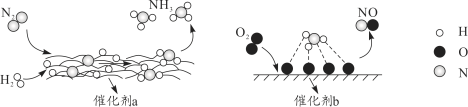
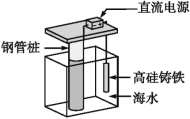
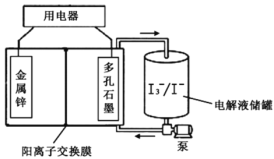
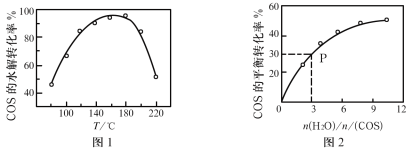
题目内容
【题目】甲醇是重要的化工原料,具有广泛的开发和应用前景。在体积可变的密闭容器中投入0.5molCO和1molH2,不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
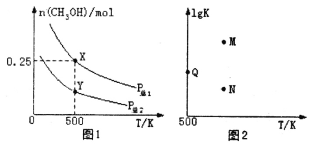
A.P总1<P总2
B.混合气体的密度不再发生变化,说明该反应已达到平衡状态
C.图2中M点能正确表示该反应平衡常数的对数(1gK)与温度的关系
D.若P总1=0.25MPa,则Y点的平衡常数Kp=64(MPa)-2
【答案】BD
【解析】
A.对于反应CO(g)+2H2(g)![]() CH3OH(g),增大压强,平衡正向移动,甲醇的物质的量增大;
CH3OH(g),增大压强,平衡正向移动,甲醇的物质的量增大;
B.容器体积可变,平衡时,容器体积不变,密度不变;
C.升高温度甲醇的物质的量减少,说明升高温度,平衡逆向移动;
D.X、Y点在相同温度下,则平衡常数相同,X点甲醇的物质的量为0.25mol,可计算平衡时各物质的量,进而计算分压,结合分压计算平衡常数。
A.对于反应CO(g)+2H2(g)![]() CH3OH(g),增大压强,平衡正向移动,甲醇的物质的量增大,由图象可知P总1>P总2,故A错误;
CH3OH(g),增大压强,平衡正向移动,甲醇的物质的量增大,由图象可知P总1>P总2,故A错误;
B.容器体积可变,达到平衡时,容器体积不变,由于气体的质量不变,则密度不变,可说明达到平衡状态,故B正确;
C.升高温度甲醇的物质的量减少,说明升高温度,平衡逆向移动,则升高温度,lgK减小,N点能正确表示该反应平衡常数的对数(1gK)与温度的关系,故C错误;
D.X、Y点在相同温度下,则平衡常数相同,X点甲醇的物质的量为0.25mol,则

则K(Y)=K(X)=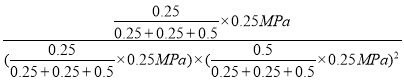 =64(MPa)-2,故D正确。
=64(MPa)-2,故D正确。
故选:BD。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1

可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。

(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
【题目】CO2是一种常见的温室气体,它的吸收和利用也成为现代科技的热门课题。
(1)恒容密闭容器中,在Cu/ZnO催化剂作用下,可用CO2制备甲醇:CO2(g) + 3H2(g)CH3OH(g) + H2O(l) △H1,已知: CH3OH(g) +![]() O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
(2)工业上用CO2催化加氢制取二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)。在两个相同的恒容密闭容器中,充入等量的反应物,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示:
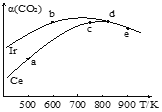
①用Ir和Ce作催化剂时,反应的活化能更低的是_________;
②a、b、c、d和e五种状态,反应一定达到平衡状态的是________,反应的ΔH ____0(填“>”、“=”或“<”);
③从状态a到c,CO2转化率不断增大的原因是__________;
④已知T℃下,将2 molCO2和6 molH2通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总压强p/1000kPa | 1.0 | 0.83 | 0.68 | 0.60 | 0.60 |
该反应平衡时CO2的转化率为___________。
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,得到NH4HCO3溶液,则反应NH4++HCO3-+H2ONH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11 )。