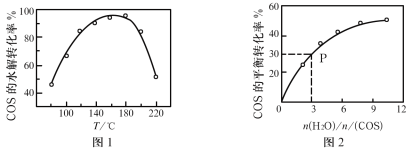
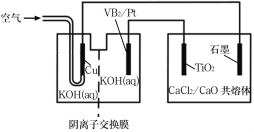
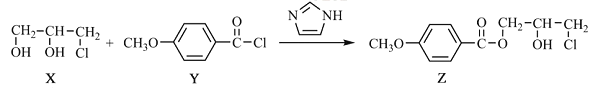
题目内容
【题目】常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的![]() (如图)。
(如图)。
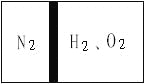
然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。则反应前H2和O2的物质的量之比为___。(请简要写出计算过程)
【答案】4:5
【解析】
中间活塞可动,说明左右压强相等,气体的物质的量之比等于体积之比,反应后恢复至原来的温度,活塞正好停留在容器的中间,说明反应后左右气体的物质的量相等,右室中气体可使带火星的木条复燃,说明氧气过量,利用方程式计算。
设氮气的物质的量为1mol,左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的1/4,左右压强相等,气体的物质的量之比等于体积之比,H2和O2的物质的量为3mol,点燃H2和O2的混合气体,反应方程式为2H2+O2![]() 2H2O,反应后活塞正好停留在容器的中间,反应后左右气体的物质的量相等,右室中气体可使带火星的木条复燃则剩余氧气为1mol,参加反应的H2和O2共2mol,其中n(H2)=4/3mol,n(O2)=2/3mol,原气体中n(H2)=
2H2O,反应后活塞正好停留在容器的中间,反应后左右气体的物质的量相等,右室中气体可使带火星的木条复燃则剩余氧气为1mol,参加反应的H2和O2共2mol,其中n(H2)=4/3mol,n(O2)=2/3mol,原气体中n(H2)=![]() mol,n(O2)=
mol,n(O2)=![]() mol+1mol=
mol+1mol=![]() mol,反应前H2和O2的物质的量之比为
mol,反应前H2和O2的物质的量之比为![]() :
:![]() =4:5,故答案为:4:5。
=4:5,故答案为:4:5。

【题目】CO2是一种常见的温室气体,它的吸收和利用也成为现代科技的热门课题。
(1)恒容密闭容器中,在Cu/ZnO催化剂作用下,可用CO2制备甲醇:CO2(g) + 3H2(g)CH3OH(g) + H2O(l) △H1,已知: CH3OH(g) +![]() O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
(2)工业上用CO2催化加氢制取二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)。在两个相同的恒容密闭容器中,充入等量的反应物,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示:
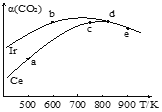
①用Ir和Ce作催化剂时,反应的活化能更低的是_________;
②a、b、c、d和e五种状态,反应一定达到平衡状态的是________,反应的ΔH ____0(填“>”、“=”或“<”);
③从状态a到c,CO2转化率不断增大的原因是__________;
④已知T℃下,将2 molCO2和6 molH2通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总压强p/1000kPa | 1.0 | 0.83 | 0.68 | 0.60 | 0.60 |
该反应平衡时CO2的转化率为___________。
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,得到NH4HCO3溶液,则反应NH4++HCO3-+H2ONH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11 )。