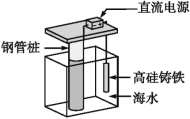
题目内容
【题目】已知如下三个实验均能发生化学反应:
① | ② | ③ |
将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
下列判断正确的是
A.实验①中铁作还原剂B.实验②中![]() 既显氧化性又显还原性
既显氧化性又显还原性
C.实验③中发生的是置换反应D.上述实验证明氧化性:![]()
【答案】A
【解析】
A. 由①中发生Fe+Cu2+=Fe2++Cu,Fe元素的化合价升高,则Fe作还原剂,故A正确;
B.向硫酸亚铁溶液中滴入几滴氯水:2Fe2++Cl2=2Fe3++2Cl-,反应中Fe元素的化合价升高,则Fe2+只能表现还原性,故B错误;
C. 置换反应是单质与化合物反应生成新单质和新化合物,而③中发生Cu+2Fe3+=2Fe2++Cu2+,生成物中没有单质,则不是置换反应,故C错误;
D. 由发生的三个反应利用氧化剂的氧化性大于氧化产物的氧化性可知上述实验证明氧化性为Fe3+>Cu2+>Fe2+,故D错误;
答案选A。

【题目】Ⅰ.呋喃甲酸是一种抗生素,在食品工业中作防腐剂,也作涂料添加剂医药、香料等中间体,可用呋喃甲醛制备,其实验原理和制备步骤如下:
2![]() +NaOH→
+NaOH→![]() +
+![]() H<0
H<0
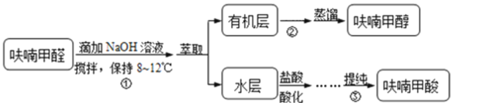
步骤③提纯过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
(1)步骤①的关键是控制温度,其措施有:磁力搅拌、__________和缓慢滴加![]() 溶液。
溶液。
(2)步骤②中,加入无水![]() 的作用_______。
的作用_______。
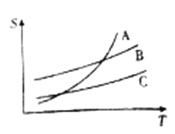
(3)呋喃甲酸在A、B、C三种溶剂中溶解度(S)随温度(T)变化的曲线如图。步骤③提纯时合适的溶解试剂是________。
Ⅱ.利用呋喃甲酸制取的呋喃甲酸正丁酯是一种优良的有机溶剂。某化学兴趣小组在实验室用呋喃甲酸和正丁醇制备呋喃甲酸正丁酯,有关物质的相关数据及实验装置如图所示:
化合物 | 相对分子质量 | 密度( | 沸点(℃) | 溶解度(g/100g水) |
呋喃甲酸 | 112 | 1.322 | 230-232 | 4.33 |
正丁醇 | 74 | 0.81 | 117.3 | 9 |
呋喃甲酸正丁酯 | 168 | 1.053 | 136.1 | 0.7 |
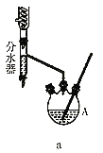

分水器的操作方法:先将分水器装满水(水位与支管口相平),再打开活塞,准确放出一定体积的水。在制备过程中,随着加热回流,蒸发后冷凝下来的有机液体和水在分水器中滞留分层,水并到下层(反应前加入的)水中;有机层从上面溢出,流回反应容器。当水层增至支管口时,停止反应。
呋喃甲酸正丁酯合成和提纯步骤为:
第一步:取足量的正丁醇和![]() 呋喃甲酸混合加热发生酯化反应,反应装置如图a所示(加热仪器已省略);
呋喃甲酸混合加热发生酯化反应,反应装置如图a所示(加热仪器已省略);
第二步:依次用水、饱和![]() 溶液、水对烧瓶中的产品洗涤并干燥;
溶液、水对烧瓶中的产品洗涤并干燥;
第三步:用装置b蒸馏提纯。
回答有关问题:
(4)装置A的名称_________。
(5)实验中使用分水器的优点有________。
(6)第二步用饱和![]() 溶液洗涤的目的是______。
溶液洗涤的目的是______。
(7)若实验中得到呋喃甲酸正丁酯![]() ,则呋喃甲酸正丁酯的产率为________。实验中呋喃甲酸正丁酯的实际产率总是小于此计算值,不可能原因是_______(填字母代号)。
,则呋喃甲酸正丁酯的产率为________。实验中呋喃甲酸正丁酯的实际产率总是小于此计算值,不可能原因是_______(填字母代号)。
A.分水器收集的水里含呋喃甲酸正丁酯
B.该实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
【题目】CO2是一种常见的温室气体,它的吸收和利用也成为现代科技的热门课题。
(1)恒容密闭容器中,在Cu/ZnO催化剂作用下,可用CO2制备甲醇:CO2(g) + 3H2(g)CH3OH(g) + H2O(l) △H1,已知: CH3OH(g) +![]() O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
(2)工业上用CO2催化加氢制取二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)。在两个相同的恒容密闭容器中,充入等量的反应物,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示:
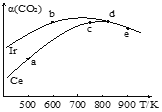
①用Ir和Ce作催化剂时,反应的活化能更低的是_________;
②a、b、c、d和e五种状态,反应一定达到平衡状态的是________,反应的ΔH ____0(填“>”、“=”或“<”);
③从状态a到c,CO2转化率不断增大的原因是__________;
④已知T℃下,将2 molCO2和6 molH2通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总压强p/1000kPa | 1.0 | 0.83 | 0.68 | 0.60 | 0.60 |
该反应平衡时CO2的转化率为___________。
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,得到NH4HCO3溶液,则反应NH4++HCO3-+H2ONH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11 )。