题目内容
1.化合物G是一种医药中间体,常用于制备抗凝血药.可以通过如图所示的路线合成: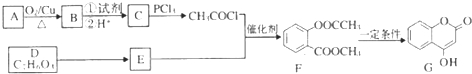
已知:RCOOH$\stackrel{PCl_{3}}{→}$RCOCl
请回答下列问题:
(1)B→C的转化所加的试剂可能是银氨溶液或新制氢氧化铜悬浊液,C+E→F的反应类型是取代反应
(2)有关G的下列说法正确的是bd
a、属于芳香烃
b、可以发生水解、加成、氧化、酯化等反应
c.能与FeCl溶液发生显色反应
d.1molG最多可以跟4molH2反应
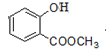
(3)E的结构简式为
(4)F与足量NaOH浴液充分反应的化学方程式为
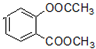 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+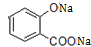 +H2O.
+H2O.(5)E的同分异构体中,既能发生水解反应,又能与FeCl3溶液能发生显色反应的还有9种,其中苯环上有两种不同化学环境的氢原子的是
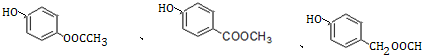 (写出其中一种的结构简式).
(写出其中一种的结构简式).(6)已知:氯苯用10%-15%的氢氧化钠溶液在360-3900C、28-30MPa条件水解再酸化可制取苯酚,而酚羟基一般不易直接与羧酸酯化,苯甲酸苯酚酯(
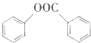 )是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)
)是一种重要的有机合成中间体,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓硫酸}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
分析 根据题中各物转化关系,结合信息RCOOH$\stackrel{PCl_{3}}{→}$ RCOCl,可知C为CH3COOH,由A→B→C的转化条件可知,A被氧化成B,B再被氧化成C,所以B为CH3CHO,A为CH3CH2OH,根据F的结构可知E发生取代反应生成F,所以E为 ,根据D的分子式和E的结构可知,D与甲醇反应生成E,所以D的结构简式为
,根据D的分子式和E的结构可知,D与甲醇反应生成E,所以D的结构简式为 ,以苯、甲苯为原料制取
,以苯、甲苯为原料制取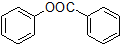 ,可以先将苯中引入羟基,生成酚,甲苯氧化成苯甲酸,再酯化可得产品,据此答题.
,可以先将苯中引入羟基,生成酚,甲苯氧化成苯甲酸,再酯化可得产品,据此答题.
解答 解:根据题中各物转化关系,结合信息RCOOH$\stackrel{PCl_{3}}{→}$ RCOCl,可知C为CH3COOH,由A→B→C的转化条件可知,A被氧化成B,B再被氧化成C,所以B为CH3CHO,A为CH3CH2OH,根据F的结构可知E发生取代反应生成F,所以E为 ,根据D的分子式和E的结构可知,D与甲醇反应生成E,所以D的结构简式为
,根据D的分子式和E的结构可知,D与甲醇反应生成E,所以D的结构简式为 ,
,
(1)B→C的转化是醛基氧化成羧基,所以所加的试剂可能是银氨溶液或新制氢氧化铜悬浊液,根据上面的分析可知,C+E→F的反应类型是取代反应,
故答案为:银氨溶液或新制氢氧化铜悬浊液;取代反应;
(2)根据G的结构简式可知,G中有酯基、羟基、碳碳双键、苯环,a.G中有氧元素,所以不属于芳香烃,故a错误;
b.G中有酯基、羟基、碳碳双键,可以发生水解、加成、氧化、酯化等反应,故b正确;
c.G中没有酚羟基,所以不能与FeCl3溶液发生显色反应,故c错误;
d.G中有苯环,一个苯环可以与三个H2加成,一个碳碳双键可以与一个H2加成,所以1mol G最多可以跟4mol H2反应,故d正确;
故答案为:bd;
(3)根据上面的分析可知,E的结构简式为 ,故答案为:
,故答案为: ;
;
(4)F中有两个酯基与足量NaOH溶液充分反应生成酚羟基也与氢氧化钠反应,所以反应的化学方程式为 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O,
+H2O,
故答案为: +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O;
+H2O;
(5)E为 ,E的同分异构体中同时满足下列条件①能发生水解反应,说明有酯基,酯基有苯酚与乙酸形成的、苯甲醇与甲酸形成的、苯甲酸与甲醇形成的3种,②与FeCl3溶液能发生显色反应,有酚羟基,酯基与酚羟基分别处于邻、间、对三种情况,共有9种同分异构体;满足③苯环上有两种不同化学环境的氢原子,说明有两个基团处于苯环的对位,这样的结构简式有
,E的同分异构体中同时满足下列条件①能发生水解反应,说明有酯基,酯基有苯酚与乙酸形成的、苯甲醇与甲酸形成的、苯甲酸与甲醇形成的3种,②与FeCl3溶液能发生显色反应,有酚羟基,酯基与酚羟基分别处于邻、间、对三种情况,共有9种同分异构体;满足③苯环上有两种不同化学环境的氢原子,说明有两个基团处于苯环的对位,这样的结构简式有 ,
,
故答案为:9; ;
;
(6)以苯、甲苯为原料制取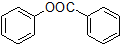 ,可以先将苯中引入羟基,生成酚,甲苯氧化成苯甲酸,再酯化可得产品,所以该化合物的合成路线流程图为
,可以先将苯中引入羟基,生成酚,甲苯氧化成苯甲酸,再酯化可得产品,所以该化合物的合成路线流程图为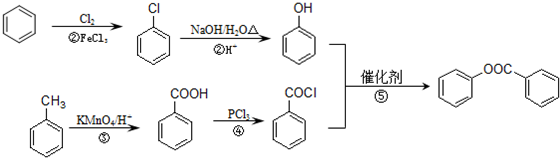 ,
,
故答案为: .
.
点评 本题主要考查有机推断与合成,解题的关键是利用官能团的性质与转化,结合题中信息进行物质推断,中等难度,答题时注意有机基础知识的灵活运用.

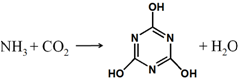 CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含有σ键又含有π键 | ||
| C. | 分子中既含极性键,又含非极性键 | D. | 生成该物质的上述反应为中和反应 |
| A. | 向明矾溶液中加入足量的烧碱溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 纯碱溶液呈碱性的原因:CO32-+H2O?HCO3-+OH- |
| A. | 向NaAlO2溶液中通入足量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | (NH4)2Fe(SO4)2溶液中加入少量氢氧化钡溶液:NH4++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 工业上用氨水吸收二氧化硫:2NH3.H2O+SO2═2NH4++SO32- | |
| D. | 磁性氧化铁溶于稀硝酸3Fe2++4H++NO3-═3Fe3++NO↑+2H2 |
| 选项 | 实 验 目 的 | 实 验 操作 |
| A | 在溶液中将MnO4+完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| B | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Mg 2++2HC03-+Ca 2++2OH -→MgC03↓+CaC03↓+2H20 | |
| B. | Mg 2++2HC03-+2Ca 2++4OH -→Mg(OH)2↓+2CaC03↓+2H20 | |
| C. | Mg 2++3HC03-+3Ca 2++5OH -→Mg(OH)2↓+3CaC03↓+3H20 | |
| D. | Ca2++C032-→CaCO3↓ |
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH2COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
(1)科研小组为了研究影响上述方案的相关因素,在实验室中做了如表三组实验.请完成实验设计表(表中不要留空格):
| 编号 | 实验目的 | 污水的体积(mL) | 温度(℃) | 过氧化氢的质量分数 |
| ① | 为以下实验作参照 | 25 | 20 | 10% |
| ② | 过氧化氢浓度的影响 | 25 | 20 | 30% |
| ③ | 温度的影响 | 25 | 80 | 10% |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe2+ | 7.4 | 8.9 |
| Fe3+ | 2.2 | 3.2 |
(3)小组人员发现:废水存放一段时间后,颜色发生了一定的变化.现取一定量的废水,对其中所含铁元素的存在形式进行研究.
①提出假设
假设一:只有Fe2+;
假设二:只有Fe3+;
假设三:两者都有.
②验证假设
为验证假设,请你设计一个实验方案,写出实验步骤、预期现象和结论:(限选试剂:稀HNO3溶液,稀NaOH溶液,KSCN溶液,KMnO4酸性溶液,淀粉KI溶液)
| 实验步骤 | 预期现象及结论 |
| 第一步,取少量废水于试管中,滴加几滴KSCN溶液,振荡,观察现象. | 如果无现象,则假设一成立,如果溶液变红,则进行下一步实验 |
| 另取少量废水于试管中,滴加少量的KMnO4酸性溶液,振荡,观察现象 | 如果紫色退去,则假设三成立;如果紫色未退去,则假设二成立 |