题目内容
15.烃A的相对分子质量是106,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色.当用FeBr3作催化剂时,能与溴反应,生成的一溴代物只有一种,则烃A的名称是对二甲苯,它生成一溴代物的化学方程式是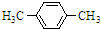 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$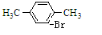 +HBr.
+HBr.
分析 设出此烃的分子式,求出CH原子个数,然后依据所给条件确定结构简式即可,依据苯与溴的取代反应书写化学反应方程式.
解答 解:假设烃A分子式为CxHy,则 12x+y=106,解得x=8 y=10所以该烃的分子式为C8H10,又它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,当用铁粉做催化剂,能与溴反应,生成的一溴代物只有一种,则A属于苯的同系物.并且存在两个相同的对位取代基,因此结合分子式可知A的名称为:对二甲基苯,化学反应方程式为: +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$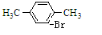 +HBr,
+HBr,
故答案为:对二甲苯; +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$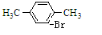 +HBr.
+HBr.
点评 本题主要考查的是有机物结构式的确定,掌握“不能使溴水褪色”,能使“酸性高锰酸钾褪色”的结构是关键,难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
5.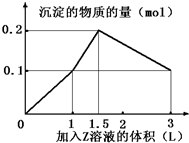 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )| A. | 氯化铝、氯化铁、氢氧化钠 | B. | 氯化铝、氯化镁、氢氧化钠 | ||
| C. | 偏铝酸钠、氯化钡、硫酸 | D. | 偏铝酸钠、氢氧化钡、硫酸 |
6.下列操作不能达到实验目的是( )
| 选项 | 实 验 目 的 | 实 验 操作 |
| A | 在溶液中将MnO4+完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| B | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
3.将标准状况下VL的CO2气体通入500mL4mol/L的NaOH溶液中,下列对所得溶液的叙述不正确的是( )
| A. | 当V<22.4L时,随着CO2气体的通入,溶液中由水电解出的c(H+)逐渐增大 | |
| B. | 当V=22.4L时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | |
| C. | 当22.4L<V<44.8L时,所得溶液中一定存在:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 当V=44.8L时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+C(H2CO3) |
10.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH2COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
7.下列有关实验说法错误的是( )
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通入足量的饱和NaHCO3溶液中除去SO2 | |
| C. | 用洁净的铂丝蘸取某食盐,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐中不含KIO3 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由浅红色变成红色,冷却后溶液由红色变成淡红色,说明HCO3-在水溶液中存在水解平衡 |
10.研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长.现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解).其流程如图:
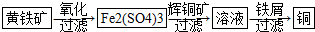
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1 2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸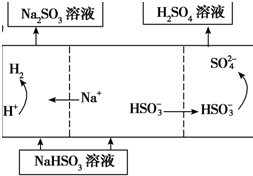 |
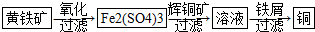
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
 一种有机化合物的结构简式为:
一种有机化合物的结构简式为: