题目内容
18.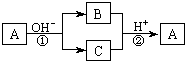 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
| A. | X元素可能为Al | B. | X元素一定为非金属元素 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②不可能都为氧化还原反应 |
分析 A为单质,B、C为化合物,所以①②一定为氧化还原反应,据这两个反应特点知甲元素在①反应中化合价既升高,又降低,故A一定不是金属,为非金属元素,①②不互为可逆反应,因为条件不同,据此答题.
解答 解:A为单质,B、C为化合物,所以①②一定为氧化还原反应,又因为A、B、C均含有元素X,因此反应①是歧化反应,根据这两个反应特点知X元素在①反应中化合价既升高,又降低,A中元素化合价为0,金属没有负价,故A一定不是金属,为非金属元素,
A.由上述分析可知,A为非金属,若X为Al,铝和强碱反应生成偏铝酸钠和氢气,偏铝酸钠与氢气不能反应,故A错误;
B.根据上述分析,X元素一定是非金属元素,故B正确;
C.反应①和②的反应条件不同,不能互为可逆反应,故C错误;
D.反应①和②一定有元素的化合价升降,则一定均为氧化还原反应,故D错误.
故选B.
点评 本题以推断题形式,考查了氧化还原反应,涉及归中规律和歧化反应的应用,根据金属无负价,能发生归中反应和歧化反应的一定是非金属元素.

练习册系列答案
相关题目
9.某基态原子的价电子排布式为4s24p1,则下列说法错误的是( )
| A. | 该元素在周期表中的位置是第4周期第ⅢA族 | |
| B. | 该元素原子核外有4个电子层 | |
| C. | 该元素原子最外层共有3个电子 | |
| D. | 该元素基态原子的电子排布式为[Ar]4s24p1 |
6.下列叙述错误的是( )
| A. | 13C和14C互为同位素 | B. | 1H和2H是不同的核素 | ||
| C. | 6Li和7Li的电子数相等 | D. | 14C和14N属于同种元素 |
13.酸根离子RO3-所含电子比NO3-多10个,则下列说法中正确的是( )
| A. | RO3-中R元素的化合价与NO3-中的N元素的化合价相同 | |
| B. | R原子的电子层数与N原子电子层数相同 | |
| C. | RO3-中的R元素与NO3-中N元素都只能被还原,不能被氧化 | |
| D. | R元素在自然界中既以游离态又以化合态存在 |
3.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物.请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
| A. | ZnC2水解生成乙烷(C2H6 ) | B. | Al4C3水解生成丙炔(C3H4) | ||
| C. | Mg2C3水解生成丙炔(C3H4) | D. | Li2C2水解生成乙烯(C2H4) |
10.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是
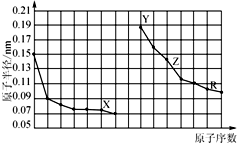

| A. | 同周期元素中,X的气态氢化物最稳定 | |
| B. | Y、Z的单质在空气中加热,均发生燃烧反应 | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z. |
14.下列四种元素中,其单质氧化性最强的是( )
| A. | 原子含有未成对电子最多的第二周期元素 | |
| B. | 位于元素周期表中第三周期ⅢA族的元素 | |
| C. | 原子最外层电子排布为2s22p6的元素 | |
| D. | 原子最外层电子排布为2s22p5的元素 |
15.下列反应在恒容密闭容器中进行,aA(g)+bB(g)?mC(g)+nD(g),表示其已达到平衡状态的叙述中正确的是( )
| A. | 平衡时的压强与反应起始的压强之比为$\frac{m+n}{a+b}$ | |
| B. | 用物质A表示的反应速度与物质C表示的反应速度之比为$\frac{a}{m}$ | |
| C. | 体系内的气体密度不再发生变化 | |
| D. | 单位时间内bmol B参加反应同时有a mol A生成 |
 .
.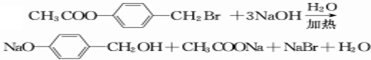 .
.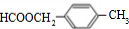 .
.