题目内容
14.下列四种元素中,其单质氧化性最强的是( )| A. | 原子含有未成对电子最多的第二周期元素 | |
| B. | 位于元素周期表中第三周期ⅢA族的元素 | |
| C. | 原子最外层电子排布为2s22p6的元素 | |
| D. | 原子最外层电子排布为2s22p5的元素 |
分析 根据原子结构判断各选项中元素,根据结构特点与非金属性判断,非金属性越强,单质的氧化性越强.
解答 解:A、原子含未成对电子最多的第二周期元素是N元素,氮气分子中含有三键,氮气的化学性质稳定,
B、位于元素周期表中第三周期ⅢA族的元素为Al,属于金属元素,
C、基态原子最外层电子排布为2s22p6的元素是Ne元素,最外层电子数为8,化学性质稳定,
D、原子最外层电子排布为3s23p5的元素是Cl元素,
非金属性Cl>N>Ne>Al,则氯气的氧化性最强,
故选:D.
点评 本题考查结构位置以性质关系,比较基础,注意基础知识的掌握,注意把握单质氧化性的判断方法.

练习册系列答案
相关题目
17.下列各组反应(表中物质均为反应物)起始时,产生H2的速率最大的是( )
| 编号 | 金属(粉末) | 物质的量(mol) | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Mg | 0.1 | 6mol/L HNO3 | 10mL | 60℃ |
| B | Mg | 0.1 | 1.5mol/L HCl | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| D | Mg | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
18.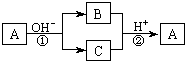 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
( )
 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
| A. | X元素可能为Al | B. | X元素一定为非金属元素 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②不可能都为氧化还原反应 |
2.下列说法中不正确的是( )
①质子数相同的粒子一定属于同一种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素的原子
⑤一种元素不可以形成不同的单质
⑥某种元素的相对原子质量取整数,就是其质量数.
①质子数相同的粒子一定属于同一种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素的原子
⑤一种元素不可以形成不同的单质
⑥某种元素的相对原子质量取整数,就是其质量数.
| A. | ①②⑤⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
9.一种燃料电池,以镍板为电极插入KOH溶液,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+$\frac{7}{2}$O2+14e-=14OH-.有关推断不正确的是( )
| A. | 通氧气的电极为负极 | |
| B. | 参加反应的O2与C2H6的物质的量之比为7:2 | |
| C. | 电池工作一段时间后,KOH的物质的量浓度减小 | |
| D. | 电池工作时,溶液中OH-离子向正极移动 |
19.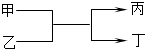 若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
 若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 钠和氢气 | B. | 氟和氧气 | C. | 碳和硅 | D. | 氯气和溴 |
6.元素砹(At)原子序数为85,下面关于该元素说法不正确的是( )
| A. | AgAt 不溶于水 | |
| B. | HAt很不稳定 | |
| C. | At的单质是白色固体 | |
| D. | 该元素位于元素周期表第六周期、第十七列 |
3.有100mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如图所示,则( )

| A. | x为强酸,y为弱酸 | |
| B. | 随着稀释的进行,y的电离程度减小 | |
| C. | 稀释前x、y的物质的量浓度相等 | |
| D. | 稀释后的x、y分别分别与足量的锌反应,y放出的氢气多 |
4. 如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
 如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为 Fe 和碳棒,则 X 为碳棒,Y 为 Fe | |
| C. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为 X>Y |