题目内容
10.W、X、Y、Z为原子序数递增的四种短周期元素.W是原子半径最小的元素,X的一种核素在考古时常用来鉴定一些文物的年代,Y是植物生长所需化学肥料中主要的营养元素之一,Z原子的最外层电子数是X原子最外层电子数的1.5倍.下列说法正确的是( )| A. | 氢化物的沸点:Z一定高于Y | |
| B. | 最高价氧化物对应水化物的酸性:X强于Y | |
| C. | W、X、Y、Z都能分别与氯元素形成共价化合物 | |
| D. | 仅由W、Y、Z三种元素组成的化合物不可能属于盐类 |
分析 W、X、Y、Z为原子序数递增的四种短周期元素,W是原子半径最小的元素,则W为H元素,X的一种核素在考古时常用来鉴定一些文物的年代,则W为C元素,Y是植物生长所需化学肥料中主要的营养元素之一,应为N或P元素,Z原子的最外层电子数是X原子最外层电子数的1.5倍,则最外层电子数为6,为O或S元素,以此解答该题.
解答 解:W、X、Y、Z为原子序数递增的四种短周期元素,W是原子半径最小的元素,则W为H元素,X的一种核素在考古时常用来鉴定一些文物的年代,则W为C元素,Y是植物生长所需化学肥料中主要的营养元素之一,应为N或P元素,Z原子的最外层电子数是X原子最外层电子数的1.5倍,则最外层电子数为6,为O或S元素.
A.如氢化物分别为N2H4、H2O,则N2H4沸点较高,故A错误;
B.非金属性N(或P)>C,则最高价氧化物对应水化物的酸性:X弱于Y,故B错误;
C.W、X、Y、Z可分别为H、C、N(P)、O(S),均为非金属元素,都能分别与氯元素形成共价化合物,故C正确;
D.仅由W、Y、Z三种元素组成的化合物可能为NH4NO3,属于盐,故D错误;
故选C.
点评 本题考查原子结构与元素周期律知识,侧重于学生的分析能力的考查,把握原子结构特点为解答该题的关键,注意Y、Z元素不确定性,难度中等.

练习册系列答案
相关题目
1.含有Ag+、Al3+、Mg2+、Ba2+等四种金属离子的混合溶液.欲使上述四种离子分别以沉淀形式从溶液中分离出来.下列加入试剂的顺序能达到实验目的是( )
| A. | NaOH、NaCl、HCl、Na2SO4 | B. | NaCl、Na2SO4、NaOH、HCl | ||
| C. | NaCl、NaOH、Na2SO4、HCl | D. | Na2SO4、NaOH、NaCl、HCl |
18.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
5.下列有关离子方程式与所述事实相符的是( )
| A. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| B. | 某溶液中存在大量Fe3+、S2-、Cl-、Na+,加入NaOH溶液发生反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 向AlCl3溶液中投入过量的Na:Na+Al3++2H2O=Na++AlO2-+2H2↑ | |
| D. | 将Na2O2固体投入H218O中:2H218O+2Na2O2=4OH-+4Na++18O2↑ |
15.下列除去杂质(括号内为杂质)的方法正确的是( )
①乙烷(乙烯):光照条件下通入Cl2,气液分离
②乙炔(硫化氢):酸性高锰酸钾溶液,洗气
③苯(苯酚):用浓溴水洗涤,分液
④乙醇(乙酸):加足量生石灰,蒸馏.
①乙烷(乙烯):光照条件下通入Cl2,气液分离
②乙炔(硫化氢):酸性高锰酸钾溶液,洗气
③苯(苯酚):用浓溴水洗涤,分液
④乙醇(乙酸):加足量生石灰,蒸馏.
| A. | 都不正确 | B. | ②③ | C. | ④ | D. | ③④ |
2. CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
 CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )| A. | 铊的元素符号为Tl | B. | 铊原子的中子数=204-81=123 | ||
| C. | 铊位于第六周期ⅢA族 | D. | 铊的金属性比铝的金属性强 |
19.已知2H2(g)+O2(g)→2H2O(g)+483.6kJ.下列说法或表达正确的是( )
| A. | 在相同的条件下,2mol氢气与1 mol氧气的总能量小于2mol 水蒸气的总能量 | |
| B. | H2(g)+$\frac{1}{2}$ O2(g)→H2O(1)+Q1;Q1>241.8kJ | |
| C. | 氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | |
| D. | 任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
20. 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
请回答下列问题:
(1)写出NaHCO3和盐酸发生反应的离子方程式HCO3-+H+=CO2↑+H2O
(2)由上述实验得出的结论是:Na2CO3溶液与盐酸的反应是放热(填“吸热”或“放热”下同)反应,NaHCO3溶液与盐酸反应是吸热反应
(3)在如图中画出Na2CO3和盐酸反应前后能量变化曲线(标注“反应物总能量”和“生成物总能量”)
 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:| 序号 | 35mL试剂 | 固体 | 混合温度前/℃ | 混合温度后/℃ |
| ① | 水 | 2.5gNaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2gNa2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5gNaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2gNa2CO3 | 20.0 | 25.1 |
(1)写出NaHCO3和盐酸发生反应的离子方程式HCO3-+H+=CO2↑+H2O
(2)由上述实验得出的结论是:Na2CO3溶液与盐酸的反应是放热(填“吸热”或“放热”下同)反应,NaHCO3溶液与盐酸反应是吸热反应
(3)在如图中画出Na2CO3和盐酸反应前后能量变化曲线(标注“反应物总能量”和“生成物总能量”)
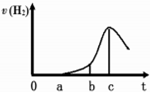 某兴趣小组进行“活泼金属与酸反应”的实验.将5.4g的铝片投入500mL0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验.将5.4g的铝片投入500mL0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.