题目内容
7.与硫化合时,每0.5mol金属原子只失去约3.01×1023个电子的是( )| A. | Fe | B. | Mg | C. | Na | D. | Cu |
分析 根据每0.5mol金属原子只失去约3.01×1023个即0.5mol电子,所以金属的化合价变化是从0价升高到+1价,据此回答.
解答 解:金属单质和硫化合是,硫是氧化剂,金属为还原剂,每0.5mol金属原子只失去约3.01×1023个即0.5mol电子,所以金属的化合价变化是从0价升高到+1价,符合条件的金属只能是Na.
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质的量计算微粒数,掌握基础是关键,题目较简单.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
17.下列各式中,属于正确的电离方程式的是( )
| A. | HCO${\;}_{3}^{-}$═CO${\;}_{3}^{2-}$+H+ | B. | NaHSO4═Na++HSO4- | ||
| C. | H3PO4?3H++PO${\;}_{4}^{3-}$ | D. | NH3•H2O?NH${\;}_{4}^{+}$+OH- |
18.下列实验操作中,合理的是( )
| A. | 实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混合物,使液体温度迅速升到170℃ | |
| B. | 实验室制取肥皂时,待植物油、乙醇和氢氧化钠溶液的混合物加热充分反应后,冷却,用纱布滤出固态物质 | |
| C. | 验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液 | |
| D. | 验证蔗糖水解产物时,在蔗糖溶液中加入几滴稀硫酸,水浴5 min,加入新制银氨溶液 |
15.测定硫酸铜晶体中结晶水含量时,要用到下列仪器中的( )
| A. |  | B. | 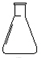 | C. |  | D. |  |
2.根据实验室测定硫酸铜晶体结晶水含量的实验,填写下列空白.
(1)实验除了需要电子天平、研钵、药匙、酒精灯、干燥器、玻璃棒、坩埚、三脚架外,还需要的仪器是泥三角、坩埚钳
(2)某学生实验后得到以下数据:
请写出结晶水x=4.97.(保留2位小数)
实验误差=-0.6%.(保留2位小数)
提示:实验误差=(实验值-理论值)/理论值)×100%
从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥
B.晶体表面已经少量失水
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失.
(1)实验除了需要电子天平、研钵、药匙、酒精灯、干燥器、玻璃棒、坩埚、三脚架外,还需要的仪器是泥三角、坩埚钳
(2)某学生实验后得到以下数据:
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.002g |
实验误差=-0.6%.(保留2位小数)
提示:实验误差=(实验值-理论值)/理论值)×100%
从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥
B.晶体表面已经少量失水
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失.
12.在一定条件下,2SO2(g)+O2(g)?2SO3(g)+Q(Q>0)反应已达到平衡,若保持其他条件不变,升高反应体系温度,则下列说法错误的是( )
| A. | 正、逆反应速率都增大 | B. | 正反应速率减小,逆反应速率增大 | ||
| C. | 平衡向逆反应方向移动 | D. | 混合气体中SO2的体积百分数增大 |
 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析: