题目内容
19.在一定条件下,反应2A+B?C达到平衡.(1)若升高温度,平衡向正反应方向移动,则逆反应是放热反应;
(2)若增加或减少B时,平衡不移动,则B是固或液态;
(3)若A、B、C均为气态,将6mol A、3mol B充入容积为0.5L的密闭容器中,进行反应.经6s后,此容器内压强为起始的0.6倍,则用A表示的反应速率为1.2mol•L-1•s-1,B的转化率为60%,6s末时C的物质的量浓度为3.6mol/L.
分析 (1)升温平衡向吸热的分析移动;
(2)增加或减少B时,平衡不移动,说明B的浓度没有变化,B不是气体;
(3)根据压强之比等于物质的量之比,结合方程式利用三段式法计算相关物理量,反应速率=$\frac{△c}{△t}$,转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)升温平衡正向移动,说明正反应是吸热反应,则逆反应是放热反应,故答案为:放;
(2)增加或减少B时,平衡不移动,说明B的浓度没有变化,B不是气体是固体或液态,故答案为:固或液;
(3)平衡时转化的B的物质的量为n,则
2A(g)+B(g)?C(g)
起始(mol):6mol 3mol 0
转化(mol):2n n n
平衡(mol):(6-2n) (3-n) n
反应后气体的总物质的量为(6mol-2n)+(3mol-n)+n=9mol-2n
压强之比等于物质的量之比,
则$\frac{9mol-2mol}{9mol}$=0.6,n=1.8mol,则
c(A)=$\frac{\frac{3.6mol}{0.5L}}{6s}$=1.2mol•L-1•s-1,
B的转化率为$\frac{1.8mol}{3mol}$×100%=60%,
平衡时C的浓度为$\frac{1.8mol}{0.5L}$=3.6mol/L,故答案为:1.2mol•L-1•s-1;60%;3.6mol/L.
点评 本题考查化学平衡的移动以及计算,题目难度中等,注意反应速率和转化率概念的计算应用,题目较简单.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
9.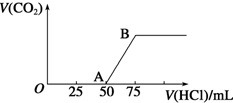 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056 L | |
| D. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 |
10.不能使KI淀粉溶液显蓝色的物质是( )
| A. | I2 | B. | KI | C. | NO2 | D. | Cl2 |
7.与硫化合时,每0.5mol金属原子只失去约3.01×1023个电子的是( )
| A. | Fe | B. | Mg | C. | Na | D. | Cu |
14.相同条件下,下列有关物质的比较中,错误的是( )
| A. | 离子半径:Cl->Br- | B. | 单质的氧化性:I2<Br2 | ||
| C. | 酸性:HCl>HF | D. | 热稳定性:H2O>H2S |
11.把Na2SO4放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是( )
| A. | H2 | B. | Ag | C. | O2 | D. | Cl2 |
8.两个体积相同的密闭容器一个盛有氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的( )
| A. | 质量 | B. | 密度 | C. | 电子总数 | D. | 分子总数 |
 我国在青藏高原发现了名为“可燃冰”的环保型新能源.?
我国在青藏高原发现了名为“可燃冰”的环保型新能源.?