题目内容
12.在一定条件下,2SO2(g)+O2(g)?2SO3(g)+Q(Q>0)反应已达到平衡,若保持其他条件不变,升高反应体系温度,则下列说法错误的是( )| A. | 正、逆反应速率都增大 | B. | 正反应速率减小,逆反应速率增大 | ||
| C. | 平衡向逆反应方向移动 | D. | 混合气体中SO2的体积百分数增大 |
分析 该反应是放热反应,升温正逆反应速率增大,平衡逆向移动,反应物浓度增大,据此分析.
解答 解:A、无论吸热反应还是放热反应,升温正逆反应速率都增大,故A正确;
B、无论吸热反应还是放热反应,升温正逆反应速率都增大,故B错误;
C、该反应是放热反应,升温平衡逆向移动,故C正确;
D、该反应是放热反应,升温平衡逆向移动,反应物浓度增大,SO2的体积百分数增大,故D正确;
故选B.
点评 本题考查了影响化学反应速率和化学平衡移动的因素,注意无论吸热反应还是放热反应,温度升高正逆反应速率都增大,题目难度不大.

练习册系列答案
相关题目
2.有机物X的键线式为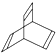 ,下列说法不正确的是( )
,下列说法不正确的是( )
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | X能使高锰酸钾酸性溶液褪色 | |
| C. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为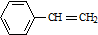 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |
7.与硫化合时,每0.5mol金属原子只失去约3.01×1023个电子的是( )
| A. | Fe | B. | Mg | C. | Na | D. | Cu |
17.对于氮、磷、砷元素的下列说法中,正确的是( )
| A. | 最高价氧化物的水化物酸性减弱的顺序是HNO3、H3PO4、H3AsO4 | |
| B. | 气态氢化物的水溶液碱性增强的顺序是NH3、PH3、AsH3 | |
| C. | 随着核电荷数的增大,其原子半径减小 | |
| D. | 随原子序数增大,气态氢化物的稳定性增强 |
1.用2-丁炔为原料制取CH3CHBrCBrClCH3,可行的反应途径是( )
| A. | 先加Cl2,再加Br2 | B. | 先加Cl2,再加HBr | C. | 先加HCl,再加HBr | D. | 先加HCl,再加Br2 |
2.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA个 | |
| B. | 通常状况下,NA 个CO2分子的体积为22.4L | |
| C. | 常温常压下,40gNaOH含有的钠离子个数为NA个 | |
| D. | 物质的量浓度为0.5mol/L的BaCL2溶液中,含有氯离子个数为NA个 |
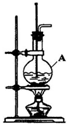 (1)在实验室制取乙烯的装置图(如图)中,A中加入的两种试剂是浓硫酸和乙醇,它们的体积比约为3:1;反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;乙烯的收集方法为排水集气法;
(1)在实验室制取乙烯的装置图(如图)中,A中加入的两种试剂是浓硫酸和乙醇,它们的体积比约为3:1;反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;乙烯的收集方法为排水集气法; 我国在青藏高原发现了名为“可燃冰”的环保型新能源.?
我国在青藏高原发现了名为“可燃冰”的环保型新能源.?