题目内容
17.下列各式中,属于正确的电离方程式的是( )| A. | HCO${\;}_{3}^{-}$═CO${\;}_{3}^{2-}$+H+ | B. | NaHSO4═Na++HSO4- | ||
| C. | H3PO4?3H++PO${\;}_{4}^{3-}$ | D. | NH3•H2O?NH${\;}_{4}^{+}$+OH- |
分析 A.碳酸氢根离子部分电离,用可逆号;
B.硫酸氢钠为强电解质,完全电离生成钠离子、氢离子、硫酸根离子;
C.磷酸为多元弱酸分步电离;
D.一水合铵为弱电解质,部分电离,用可逆号.
解答 解:A.碳酸氢根离子部分电离,电离方程式:HCO${\;}_{3}^{-}$ CO${\;}_{3}^{2-}$+H+,故A错误;
B.硫酸氢钠为强电解质,完全电离,电离方程式:NaHSO4═Na++H++SO42-,故B错误;
C.磷酸为多元弱酸分步电离,电离方程式:H3PO4?H++H2PO4-H2PO4-?H++HPO42-HPO42-?H++PO43-,故C错误;
D.一水合铵为弱电解质,部分电离,电离方程式:NH3•H2O?NH${\;}_{4}^{+}$+OH-,故D正确;
故选:D.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
8.下列物质性质与应用对应关系正确的是( )
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| B. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | 二氧化硫具有氧化性,可用于漂白纸浆 | |
| D. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用作净水剂 |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中含有的H+数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA |
12.某反应过程能量变化如图所示,下列说法正确的是( )
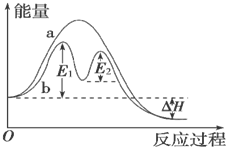

| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为放热反应,热效应等于△H | |
| C. | 改变催化剂,不能改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
2.有机物X的键线式为 ,下列说法不正确的是( )
,下列说法不正确的是( )
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | X能使高锰酸钾酸性溶液褪色 | |
| C. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |
9.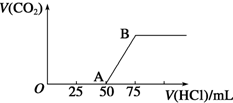 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056 L | |
| D. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 |
7.与硫化合时,每0.5mol金属原子只失去约3.01×1023个电子的是( )
| A. | Fe | B. | Mg | C. | Na | D. | Cu |


 .
.