题目内容
8. 过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下
过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下A、取3g纯碱溶于一定量的水中,搅拌至溶解完全后转入烧瓶
B、向烧瓶中缓缓加入30%H2O2
C、温度控制在15℃~20℃反应1小时
D、加入1g NaCl后静置,过滤
E、洗涤、干燥、称重
请回答下列问题:
(1)步骤D的过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗
(2)在步骤D中,加入NaCl的原因是增大钠离子浓度、降低产品的溶解度(盐析作用)
(3)在步骤C反应时,温度不能过高的原因是温度过高会导致过碳酸钠分解,降低其产率
(4)在步骤E的洗涤中,可作为洗涤剂的是d
a.蒸馏水 b.稀盐酸 c.MnSO4溶液 d.乙醇
(5)为了测定产品纯度,可用酸性KMnO4溶液进行滴定,发生的反应为:6KMnO4+5(2Na2CO3•3H2O2)+19H2SO4=K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O,准确争取0.1000g过碳酸钠样品于250ml锥形瓶中,加50ml蒸馏水溶解,用2.000×10-2mol•L-1酸性KMnO4标准溶液滴定,终点时的现象是加入最后一滴高锰酸钾溶液,溶液颜色由无色变为紫色,且半分钟内不褪色,至终点时消耗标准液15.00ml,则产品的纯度为78.5%.
分析 (1)过滤时用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
(2)钠离子浓度增大,降低过碳酸钠的溶解度;
(3)温度过高,导致过碳酸钠分解;
(4)过碳酸钠相当于带结晶双氧水的碳酸钠,具有甲酸钠、双氧水的性质,在水中溶解度较大,碳酸钠能与稀盐酸、硫酸锰反应,锰离子会催化过氧化氢的分解;
(5)加入最后一滴高锰酸钾溶液,溶液颜色由无色变为紫色,且半分钟内不褪色,说明滴定到达终点;根据方程式计算样品中过碳酸钠的质量,进而计算样品中过碳酸钠质量分数.
解答 解:(1)过滤时用到的玻璃仪器有:烧杯、玻璃棒、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(2)加入氯化钠固体,钠离子浓度增大,降低了过碳酸钠的溶解度,
故答案为:增大钠离子浓度、降低产品的溶解度(盐析作用);
(3)制备过碳酸钠是放热反应,反应过程中放出的热量使温度升高,温度过高会导致过碳酸钠分解,从而降低其产率,应控制温度不能过高,
故答案为:温度过高会导致过碳酸钠分解,降低其产率,
(4)过碳酸钠相当于带结晶双氧水的碳酸钠,具有甲酸钠、双氧水的性质,在水中溶解度较大,用水洗涤,损失较大,碳酸钠能与稀盐酸、硫酸锰反应,锰离子会催化过氧化氢的分解,促进过碳酸钠反应而导致失效,过碳酸钠难溶于乙醇,用乙醇洗涤减少损失,乙醇易挥发,利用干燥,故选:d;
(5)加入最后一滴高锰酸钾溶液,溶液颜色由无色变为紫色,且半分钟内不褪色,说明滴定到达终点;
设样品中过碳酸钠的质量为m,消耗高锰酸钾的物质的量为:2.000×10-2 mol•L-1×0.015L=3.000×10-4mol,则:
6KMnO4+5(2Na2CO3•3H2O2)+19H2SO4=K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O,
6mol 5×314g
3.000×10-4mol m
故=$\frac{5×314g×3×1{0}^{-4}mol}{6mol}$=0.0785g
故样品中过碳酸钠的质量分数为$\frac{0.0785g}{0.1g}$×100%=78.5%,
故答案为:加入最后一滴高锰酸钾溶液,溶液颜色由无色变为紫色,且半分钟内不褪色;78.5%.
点评 本题考查制备实验方案,涉及基本操作、对操作的分析评价、物质的分离提纯、氧化还原滴定测定含量等,侧重考查知识迁移运用,需要学生具备扎实的基础,题目难度中等.

| A. | 反应现象相同,反应类型相同 | B. | 反应现象相同,反应类型不同 | ||
| C. | 反应现象不同,反应类型相同 | D. | 反应现象不同,反应类型不同 |

根据以上信息回答下列问题:
(1)写出生产过程中XFe YHCl(填化学式).
(2)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液250mL于锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+.三次平行实验结果如下(平行实验结果相差不能超过1%):
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
| A. | 构造原理 | B. | 泡利原理 | C. | 洪特规则 | D. | 能量最低原理 |
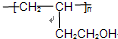 .
. 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题: .
.