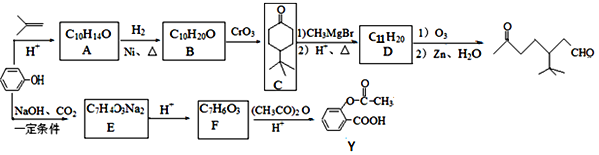
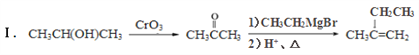题目内容
【题目】实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
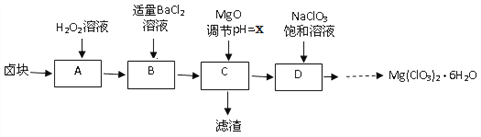

已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
②室温时一些物质的Ksp如下表:
化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为_________
(2)滤渣的成分是____________(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为______
(4)D中所发生的化学反应方程式为_____,框图中由D→......→制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②_______(请补充);③冷却结晶;④过滤洗涤。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式____________
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果_____(填“偏大”. “偏小”或“不变”)。
③若平均消耗K2Cr2O7溶液15.00 mL,则产品中Mg(ClO3)2·6H2O(其M=299g/mol)的质量分数为___________
【答案】 ![]() Fe(OH)3、BaSO4 3.3 2NaClO3+MgCl2=2NaCl↓+ Mg(ClO3)2 趁热过滤 6Fe2+Cr2O72-+14H+=6Fe3++2Cr3++7H2O 偏小 78.3%
Fe(OH)3、BaSO4 3.3 2NaClO3+MgCl2=2NaCl↓+ Mg(ClO3)2 趁热过滤 6Fe2+Cr2O72-+14H+=6Fe3++2Cr3++7H2O 偏小 78.3%
【解析】(1)H2O2属于共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)中的亚铁离子被双氧水氧化生成铁离子,加入适量的氯化钡溶液可以使硫酸根离子沉淀,加入氧化镁调节溶液的pH,根据氢氧化物的溶度积常数,可知,可使铁离子沉淀,因此滤渣中含有Fe(OH)3、BaSO4,故答案为:Fe(OH)3、BaSO4;
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,c(OH-)=![]() =2×10-11 mol/L ,则c(H+)=5×10-3 mol/L ,pH=3.3,故答案为:3.3;
=2×10-11 mol/L ,则c(H+)=5×10-3 mol/L ,pH=3.3,故答案为:3.3;
(4)根据溶解度曲线,D中NaClO3与MgCl2反应生成Mg(ClO3)2和氯化钠沉淀,反应的化学反应方程式为2NaClO3+MgCl2=2NaCl↓+ Mg(ClO3)2,Mg(ClO3)2的溶解度随温度的变化较大,由Mg(ClO3)2溶液制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②趁热过滤;③冷却结晶;④过滤洗涤,故答案为:2NaClO3+MgCl2=2NaCl↓+ Mg(ClO3)2;趁热过滤;
(5)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,Cr2O72-能将Fe2+氧化成Fe3+,反应的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
②步骤3中若滴定前不用标准液润洗滴定管,将导致消耗的标准液的体积偏大,测得剩余的亚铁离子的含量偏高,根据ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,反应消耗的亚铁离子偏少,则ClO3-含量偏少,结果偏小,故答案为:偏小;
③根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100molL-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100molL-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000molL-1-0.009mol=0.011mol,氯酸根离子的物质的量为:![]() ×0.011mol,产品中Mg(ClO3)26H2O的质量分数:(
×0.011mol,产品中Mg(ClO3)26H2O的质量分数:(![]() ×
×![]() ×0.011×299g/mol)×10×
×0.011×299g/mol)×10×![]() ×100%=78.3%,故答案为:78.3%。
×100%=78.3%,故答案为:78.3%。