题目内容
【题目】下图所示是分离混合物时常用的仪器,回答下列问题:
(1)写出仪器C、E的名称分别是_________________、_____________
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙:_____________;②花生油和水:____________
(3)若向C装置中加入碘水和足量CCl4,充分振荡后静置,观察到现象是:C内液体分两层,上层液体________色,下层液体______________色。
(4)碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:_____________
A.汽油 B.CCl4 C.酒精 D.醋酸
【答案】 分液漏斗 冷凝管 B D C 无色,紫色 CD
【解析】试题分析:(1)仪器C、E的名称为分液漏斗、冷凝管;(2)①分离NaCl固体和泥沙的方法为溶解、过滤和蒸发;②分离花生油和水的方法为分液;(3)四氯化碳萃取碘水中的碘,且四氯化碳密度比水大;(4)根据萃取剂的选取原则:被萃取的物质在萃取剂中的溶解度要比在水中的大,萃取剂不溶于水,萃取剂与被萃取的物质不反应;
解析:(1)仪器C、E的名称为分液漏斗、冷凝管;(2)①分离NaCl固体和泥沙的方法为溶解、过滤和蒸发,用到主要仪器为:漏斗、蒸发皿;②分离花生油和水的方法为分液,用到的主要仪器为:分液漏斗;(3)若向分液漏斗中加入碘水和足量CCl4,充分振荡后静置,四氯化碳萃取碘水中的碘,且四氯化碳密度比水大,会观察分液漏斗内液体分两层,上层液体无色,下层液体紫色;(4)根据萃取剂的选取原则:被萃取的物质在萃取剂中的溶解度要比在水中的大,萃取剂不溶于水,萃取剂与被萃取的物质不反应,酒精和醋酸易溶于水,不能萃取溴水中的溴,选CD。

【题目】实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
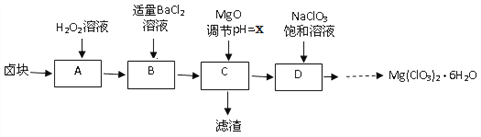

已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
②室温时一些物质的Ksp如下表:
化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为_________
(2)滤渣的成分是____________(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为______
(4)D中所发生的化学反应方程式为_____,框图中由D→......→制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②_______(请补充);③冷却结晶;④过滤洗涤。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式____________
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果_____(填“偏大”. “偏小”或“不变”)。
③若平均消耗K2Cr2O7溶液15.00 mL,则产品中Mg(ClO3)2·6H2O(其M=299g/mol)的质量分数为___________