题目内容
10.相同质量的下列各组混合气体完全燃烧,比等质量的乙烯耗氧量多的是( )| A. | 甲烷和丙烯 | B. | 丙烯和丁烯 | C. | 环丙烷与丙烯 | D. | 丙烯与丙炔 |
分析 由C~O2~CO2,4H~O2~2H2O进行比较,消耗1molO2,需要12gC,而消耗1molO2,需要4gH,可知有机物含氢量越大,等质量时消耗的O2越多,以此进行比较;
解答 解:乙烯的结构简式为CH2=CH2,最简式为CH2,
A.甲烷为CH4,含氢量比乙烯高,丙烯的最简式为CH2,含氢量与乙烯相等,所以甲烷和丙烯混合气体中含氢量比乙烯高,等质量时消耗的O2多,故A正确;
B.丙烯和丁烯的分子式分别为:C3H6、C4H8,最简式都是CH2,含氢量与乙烯相同,等质量时消耗的O2一样多,故B错误;
C.环丙烷与丙烯的分子式分别为:C3H6、C4H8,最简式都是CH2,含氢量与乙烯相同,等质量时消耗的O2一样多,故C错误;
D.丙烯的分子式为C4H8,最简式为CH2,含氢量与乙烯相同,丙炔的分子式为C3H4,最简式为$C{H}_{\frac{4}{3}}$,含氢量与乙烯小,所以丙烯与丙炔混合气体中含氢量比乙烯低,等质量时消耗的O2少,故D错误;
故选A.
点评 本题考查有机物燃烧的有关计算,掌握C元素和氢元素含量对消耗氧气的影响是解答关键,题目难度中等.

练习册系列答案
相关题目
4.生活处处有化学.下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| D. | 施肥时,草木灰(有效成分为K2CO3)和NH4Cl混合使用,会产生氨气降低肥效 |
5.在2L恒容密闭容器中充入3mol CO气体、3mol H2,发生反应:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g).CO的平衡转化率(α)与温度、压强的关系如图所示:( )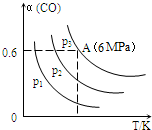

| A. | p1>p2>p3 | |
| B. | 若断裂碳氢键、氢氢键的速率相等,则该反应为平衡状态 | |
| C. | 已知从反应开始到平衡点A需要时间10min.在0~10分钟内的平均速率v(H2)=0.18mol/(L•min) | |
| D. | A点的平衡常数Kp=$\frac{1}{64}$(Kp是用平衡时各组分的分压代替其浓度的平衡常数.组分分压=混合气体总压强X该组分的物质的量分数) |
 .
.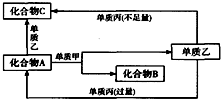 A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).
A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂). $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH
 .⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种.
.⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种. .
. .
. .
.

 .
.