题目内容
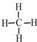
15.按要求完成下列问题(1)甲烷的结构式
 ;
;(2)乙烯的电子式
 ;
;(3)写出下列基团(或官能团)的名称或结构简式:-OH羟基、异丙基-CH(CH3)2、醛基-CHO.
分析 (1)用短线“-”代替共用电子对甲烷结构式;
(2)乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,由此写出电子式;
(3)异丙基为丙烷失去之间碳原子上的应该H原子形成的,其结构简式为:-CH(CH3)2.
解答 解:(1)甲烷分子式为CH4,碳原子与氢原子之间形成1对共用电子对,结构式为 ,故答案为:
,故答案为: ;
;
(2)乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,由此写出电子式为: ,故答案为:
,故答案为: ;
;
(3)-OH为羟基,异丙基为丙烷失去之间碳原子上的应该H原子形成的,其结构简式为:-CH(CH3)2 ,醛基的结构简式为-CHO,故答案为:羟基;-CH(CH3)2;-CHO.
点评 本题考查常见有机物的基团、官能团的结构名称、结构式等的考查,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
5.下列各组给定原子序数的元素,能形成原子数之比为1:1稳定化合物的是( )
①6和8、②7和8、③8和12、④12和17、⑤20和35.
①6和8、②7和8、③8和12、④12和17、⑤20和35.
| A. | ①②③ | B. | ①②④ | C. | ②③⑤ | D. | ③④⑤ |
3.元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度.表为部分短周期元素的电负性.请回答下列问题.
(1)根据表给出的数据,可知元素的电负性越大,非金属性(填“金属性”或“非金属性”)越强.
(2)推测Y为Na(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程 .
.
(3)比较Y与Li的金属性强弱,可以选用的方法是ab.
a.Y单质和Li分别与水反应的剧烈程度
b.Y与Li最高价氧化物对应水化物碱性的强弱
c.Y单质与LiCl溶液反应
d.比较二者原子半径大小.
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
(2)推测Y为Na(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程
 .
.(3)比较Y与Li的金属性强弱,可以选用的方法是ab.
a.Y单质和Li分别与水反应的剧烈程度
b.Y与Li最高价氧化物对应水化物碱性的强弱
c.Y单质与LiCl溶液反应
d.比较二者原子半径大小.
10.下列实验操作方法正确的是( )
| A. | 在试管中加入2mL10%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡,再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基 | |
| B. | 将无水乙醇加热至170℃时,可以制得乙烯 | |
| C. | 用氢氧化钠溶液清洗盛过苯酚的试管 | |
| D. | 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素 |
7.能在水溶液中大量共存的一组离子是( )
| A. | H+、Al3+、NO3-、SiO32- | B. | Ca2+、Fe3+、Cl-、CO32- | ||
| C. | Na+、SO42-、OH-、NO3- | D. | NH4+、OH-、Cl-、HSO3- |
4.下列各对化合物中,化学键类型都相同的一组是( )
| A. | CCl4、KCl | B. | NaCl、HF | C. | MgCl2、NH4Cl | D. | H2S、AlCl3 |
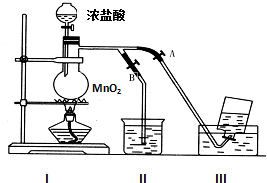 如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.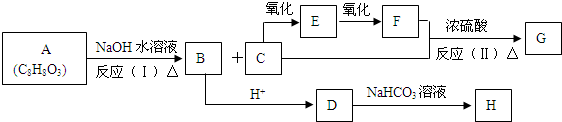
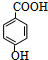 ;G的结构简式HCOOCH3;
;G的结构简式HCOOCH3; .写出D与C反应生成A的化学方程式CH3OH+
.写出D与C反应生成A的化学方程式CH3OH+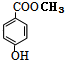 +H2O.
+H2O.
