题目内容
5.下列各组给定原子序数的元素,能形成原子数之比为1:1稳定化合物的是( )①6和8、②7和8、③8和12、④12和17、⑤20和35.
| A. | ①②③ | B. | ①②④ | C. | ②③⑤ | D. | ③④⑤ |
分析 根据原子序数判断元素,再判断形成的化合物,结合原子数目为1:1化合物的性质解答.
解答 解:①原子序数为6和8的元素分别为C、O,二者形成原子数之比为1:1的化合物为CO,故选;
②原子序数为7和8的元素分别为N、O,二者形成原子数之比为1:1的化合物为NO,故选;
③原子序数为8和12的元素分别为O、Mg,二者形成MgO,故选;
④原子序数为12和17的元素分别为Mg、Cl,二者形成化合物为MgCl2,故不选;
⑤原子序数为20和35的元素分别为Ca、Br,二者形成化合物为CaBr2,故不选,
故选A.
点评 本题考查结构性质位置关系、常见元素化合物性质等,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
15.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为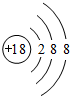 ;最活泼的非金属元素的离子结构示意图
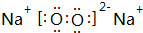
;最活泼的非金属元素的离子结构示意图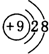 ;最活泼金属元素过氧化物的电子式
;最活泼金属元素过氧化物的电子式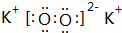 ,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
(2)写出⑤与⑦两元素最高价氧化物对应水化物反应的化学方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)设计实验方案:比较③与⑧单质氧化性的强弱,请将方案填入下表.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
 ;最活泼的非金属元素的离子结构示意图
;最活泼的非金属元素的离子结构示意图 ;最活泼金属元素过氧化物的电子式
;最活泼金属元素过氧化物的电子式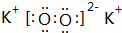 ,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.(2)写出⑤与⑦两元素最高价氧化物对应水化物反应的化学方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)设计实验方案:比较③与⑧单质氧化性的强弱,请将方案填入下表.
| 实验步骤 | 实验现象与结论 |
| 向H2S溶液中通入O2 | 溶液出现浑浊,说明O2的氧化性比S强 |
20.下列粒子中,与K+含有相同电子数的是( )
| A. | F- | B. | Cl- | C. | Br- | D. | I- |
10.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
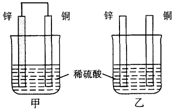

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中硫酸溶液的浓度均下降 | D. | 产生气泡的速度甲比乙慢 |
17.利用原电池原理可以探究金属的活动性.
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),锌片上发生的电极反应式是Zn-2e-=Zn2+;银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),锌片上发生的电极反应式是Zn-2e-=Zn2+;银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
 .
.
 .
.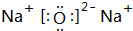 、
、 .(写两个)
.(写两个) ,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
 ;
; ;
;