题目内容
7.能在水溶液中大量共存的一组离子是( )| A. | H+、Al3+、NO3-、SiO32- | B. | Ca2+、Fe3+、Cl-、CO32- | ||
| C. | Na+、SO42-、OH-、NO3- | D. | NH4+、OH-、Cl-、HSO3- |
分析 A.氢离子、铝离子都与硅酸根离子反应;
B.钙离子、铁离子都与碳酸根离子反应;
C.四种离子之间不发生反应,能够大量共存;
D.氢氧根离子与铵根离子、亚硫酸氢根离子发生反应.
解答 解:A.H+、Al3+都与SiO32-发生反应,在溶液中不能大量共存,故A错误;
B.Ca2+、Fe3+离子都与CO32-反应,在溶液中不能大量共存,故B错误;
C.Na+、SO42-、OH-、NO3-之间不反应,在溶液中能够大量共存,故C正确;
D.NH4+、HSO3-都与OH-反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,明确离子反应发生条件为解答关键,注意掌握常见离子不能共存的情况,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
17.利用原电池原理可以探究金属的活动性.
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),锌片上发生的电极反应式是Zn-2e-=Zn2+;银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),锌片上发生的电极反应式是Zn-2e-=Zn2+;银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
18.使用氢氧燃料电池的汽车已在北京街头出现.以30% KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O O2+2H2O+4e-═4OH-
下列有关该氢氧燃料电池的说法中,正确的是( )
下列有关该氢氧燃料电池的说法中,正确的是( )
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应是 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中反应放出的热量转变为电能 | |
| D. | 电解质溶液中OH-向负极移动 |
17.下列事实不能用键能的大小来解释的是( )
| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF比H2O稳定 | |
| D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
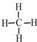 ;
; ;
; 4-甲基-3-乙基-2-己烯
4-甲基-3-乙基-2-己烯 2,2,3-三甲基戊烷.
2,2,3-三甲基戊烷.