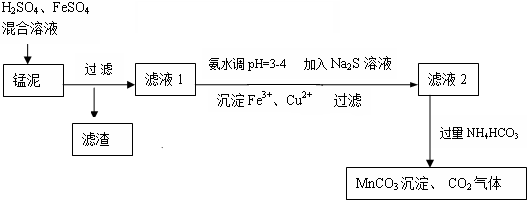
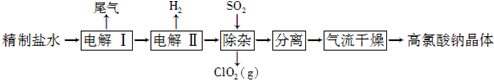
题目内容
10.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )| A. | 常温常压下,22.4 LCO2含有的原子数为3NA | |
| B. | 0.1 mol Na2O2固体含有的阴、阳离子总数是0.3NA | |
| C. | 1.8gNH4+含有的质子数为NA | |
| D. | 标准状况下,2.24 L NO与1.12 L O2混合,所得气体中分子数为0.15NA |
分析 A.常温常压下,不能使用标况下的气体摩尔体积计算二氧化碳的物质的量;
B.0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子;
C.铵根离子中含有11个质子,1.8g铵根离子的物质的量为0.1mol,含有1.1mol质子;
D.NO和氧气反应生成二氧化氮,导致混合气体的分子数减少.
解答 解:A.不是标况下,不能使用标况下的气体摩尔体积计算22.4L二氧化碳的物质的量,故A错误;
B.0.1mol过氧化钠固体中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,含有的阴、阳离子总数是0.3NA,故B正确;
C.1.8g铵根离子的物质的量为:1.8g18g/mol1.8g18g/mol=0.1mol,0.1mol铵根离子中含有的质子为:0.1mol×11=1.1mol,含有的质子数为1.1NA,故C错误;
D.标况下2.24L一氧化氮的物质的量为0.1mol,1.12L氧气的物质的量为0.05mol,由于二者混合后发生反应生成二氧化氮,则混合气体的物质的量碱性,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
5.某溶液X可能含有K+、Fe2+、Fe3+、CO32-、NO3-、SO42-中的一种或几种,现每次取该溶液100mL分别进行如下实验,下列判断不正确的是( )


| A. | 溶液中一定不存在CO32- | B. | 溶液中一定不存在Fe3+ | ||
| C. | 溶液中一定存在K+ | D. | 溶液中c(NO3-)=0.1mol/L |
18.将0.2mol两种气态烃组成的混合气体完全燃烧后得到(标准状况下)6.72L二氧化碳和7.2g水,下列说法正确的是( )
| A. | 一定有乙烯 | B. | 可能有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
5.日本福岛第一核电站泄漏出微量的钚(Pu),下列关23994Pu叙述正确的是( )
| A. | 质子数是94 | B. | 原子序数是239 | C. | 质量数是94 | D. | 中子数是239 |
15.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,该反应可写成NH4H+H2O=NH3•H2O+H2↑.下列说法错误的是( )
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水形成的溶液呈碱性 | |
| C. | NH4H与水反应时,NH4H是氧化剂 | |
| D. | NH4H固体投入少量水中,可能有两种气体产生 |
2.有机物A和B只由C、H、O中的2种或3种元素组成,等物质的量的A与B分别完全燃烧时,消耗氧气的物质的量相等,则A与B相对分子质量之差(其中n为正数)不可能为( )
| A. | 8n | B. | 18n | C. | 14n | D. | 44n |
20.羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与C02相似,高温下分解为CO和S.下列有关说法正确的是( )
| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、C02、CO、S晶体类型相同 | |
| D. | 22.4LOCS中约含有3×6.02×1023个原子 |