题目内容
1.用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图: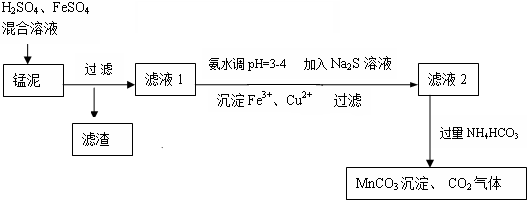
(1)用软锰矿(主要成分为MnO2)生产高锰酸钾过程中,粉碎软锰矿的主要目的是:增大接触面积,提高反应速率.
(2)锰泥中加入H2SO4、FeSO4混合溶液,反应的离子方程式是:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)c(Fe2+)c(H+)c(Fe2+)<0.7时,滤液1中能够检验出有Fe2+;c(H+)c(Fe2+)c(H+)c(Fe2+)≥0.7时,滤液1中不能检验出有Fe2+.根据上述信息回答①②③:
①检验Fe2+是否氧化完全的实验操作是:取少量滤液1,加入铁氰化钾溶液,若无蓝色沉淀生成,证明Fe2+被氧化完全.
②产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是:c(H+)c(Fe2+)c(H+)c(Fe2+)过大,在调节pH环节会多消耗氨水.
③若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的最理想方法是:b(填序号) a.NaOH溶液 b.铁粉 c.MnO
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)上述过程锰回收率可达95%,若处理1740kg的锰泥,可生产MnCO3393.3kg(已知相对分子质量:MnO2 87;MnCO3 115).
分析 H2SO4、FeSO4混合溶液与锰泥中的二氧化锰发生氧化还原反应,将亚铁氧化为三价铁,然后过滤滤去未反应掉的二氧化锰和不溶的杂质,向滤液中氨水来调节溶液的PH值,并用硫化钠来沉淀铜离子和铅离子,然后过滤滤去生成的沉淀,最后向滤液中加入过量的碳酸氢铵生成碳酸锰,
(1)粉碎软锰矿,能够增大接触面积,提高反应速率;
(2)锰泥中加入H2SO4、FeSO4混合溶液,是二氧化锰和亚铁离子发生氧化还原反应,生成铁离子,二氧化锰酸性条件下被还原;
(3)①检验Fe2+的存在加入铁氰化钾溶液,观察溶液是否变蓝;
②生产时H2SO4、FeSO4混合溶液中c(H+)c(Fe2+)c(H+)c(Fe2+)控制在0.7~1之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;③若c(H+)c(Fe2+)c(H+)c(Fe2+)>1,调节c(H+)c(Fe2+)c(H+)c(Fe2+)到0.7~1的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生氧化反应,生成氢气从而消耗氢离子,而生成亚铁离子;
(4)滤液2中的锰离子与NH4HCO3反应生成碳酸锰和二氧化碳与水;
(5)锰泥中含18%的MnO2,程锰回收率可达95%,根据关系式MnO2~~MnCO3,进行计算.
解答 解:(1)粉碎软锰矿,可以增大接触面积,提高反应速率;故答案为:增大接触面积,提高反应速率;
(2)锰泥中加入H2SO4、FeSO4混合溶液,是二氧化锰和亚铁离子发生氧化还原反应,生成铁离子,二氧化锰酸性条件下被还原,所以方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)①检验Fe2+的存在加入铁氰化钾溶液,观察溶液是否变蓝,故答案为:取少量滤液1,加入铁氰化钾溶液,若无蓝色沉淀生成,证明Fe2+被氧化完全;
②生产时H2SO4、FeSO4混合溶液中c(H+)c(Fe2+)c(H+)c(Fe2+)控制在0.7~1之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;
③若c(H+)c(Fe2+)c(H+)c(Fe2+)>1,调节c(H+)c(Fe2+)c(H+)c(Fe2+)到0.7~1的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生氧化反应,生成氢气从而消耗氢离子,而生成亚铁离子;
故答案为:c(H+)c(Fe2+)c(H+)c(Fe2+)过大,在调节pH环节会多消耗氨水;b;
(4)滤液2中的锰离子与NH4HCO3反应生成碳酸锰和二氧化碳与水,所以离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(5)锰泥中含18%的MnO2,程锰回收率可达95%,根据关系式
MnO2 ~MnCO3,
87 115
1740kg×18%×95% m,解之得m=393.3kg,
故答案为:393.3.
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写化学反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案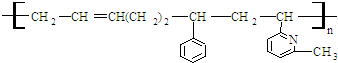
其单体可能是:
①
 ②CH2=CH
②CH2=CH ③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
⑤CH2═CH
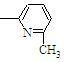 ⑥CH2=CH
⑥CH2=CH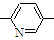 CH3
CH3正确的组合是( )
| A. | ②③⑥ | B. | ②③⑤ | C. | ①②⑥ | D. | ②④⑥ |
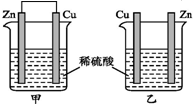
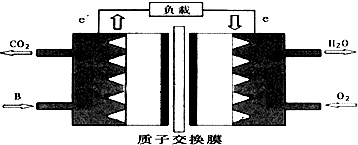
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的酸性均减弱 | D. | 产生气泡的速率甲比乙慢 |
| A. | 常温常压下,22.4 LCO2含有的原子数为3NA | |
| B. | 0.1 mol Na2O2固体含有的阴、阳离子总数是0.3NA | |
| C. | 1.8gNH4+含有的质子数为NA | |
| D. | 标准状况下,2.24 L NO与1.12 L O2混合,所得气体中分子数为0.15NA |
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(2)B的最简单气态氢化物分子空间构型三角锥形;其沸点高于同主族的其它气态氢化物原因NH3分子间能形成氢键;
(3)D的最高价氧化物对应水化物的化学键类型离子键、共价键;
(4)B、C、D、E简单离子半径大小S2->N3->O2->Na+(用元素符号表示);
(5)由A、B、C与H元素组成的一种常见的酸式盐与过量的D的最高价氧化物对应的水化物反应的离子方程式NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O,在25℃,101kPa下,2gE单质在C2气体中完全燃烧后恢复到原状态,放热18.72kJ,该反应的热化学方程式S(s)+O2(g)=SO2(g)△H=-299.52kJ/mol.
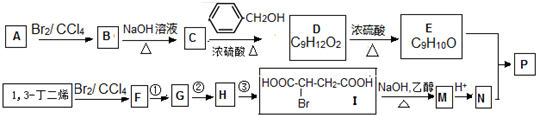
 ,
,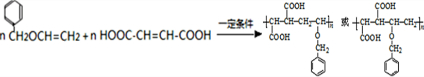 高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).
高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).
 用化学用语回答下面的问题
用化学用语回答下面的问题