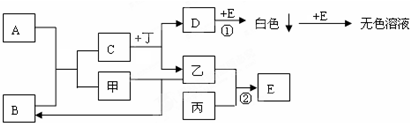
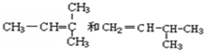题目内容
18.将0.2mol两种气态烃组成的混合气体完全燃烧后得到(标准状况下)6.72L二氧化碳和7.2g水,下列说法正确的是( )| A. | 一定有乙烯 | B. | 可能有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
分析 根据n=$\frac{m}{M}$计算7.2克水的物质的量,根据n=$\frac{V}{{V}_{m}}$计算二氧化碳的物质的量,根据H原子、C原子守恒计算混合物的平均分子组成,以此解答该题.
解答 解:两种气态烃组成的混合物0.2mol完全燃烧得6.72L二氧化碳和7.2克水,
7.2克水的物质的量为$\frac{7.2g}{18g/mol}$=0.4mol,平均分子组成中H原子数目为:$\frac{0.4mol×2}{0.2mol}$=4,
6.72L二氧化碳的物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,平均分子组成C原子数目为:$\frac{0.3mol}{0.2mol}$=1.5,
故该混合烃的平均分子式为C1.5H4,
根据C原子可知,该烃一定含有CH4,另一种烃含有4个H原子,可能为乙烯、丙炔等,只有B符合.
故选B.
点评 本题考查了混合物反应的计算,题目难度不大,注意掌握质量守恒、平均分子式法在确定有机物分子式、结构简式中的应用方法,试题培养了学生灵活应用基础知识的能力.关键是利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
9.线型弹性材料“丁苯吡橡胶”的结构简式如下:
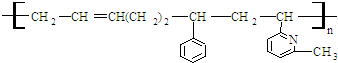
其单体可能是:
① ②CH2=CH
②CH2=CH ③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
⑤CH2═CH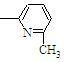 ⑥CH2=CH
⑥CH2=CH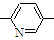 CH3
CH3
正确的组合是( )

其单体可能是:
①
 ②CH2=CH
②CH2=CH ③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
⑤CH2═CH
 ⑥CH2=CH
⑥CH2=CH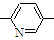 CH3
CH3正确的组合是( )
| A. | ②③⑥ | B. | ②③⑤ | C. | ①②⑥ | D. | ②④⑥ |
13.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
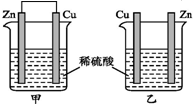

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的酸性均减弱 | D. | 产生气泡的速率甲比乙慢 |
10.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 常温常压下,22.4 LCO2含有的原子数为3NA | |
| B. | 0.1 mol Na2O2固体含有的阴、阳离子总数是0.3NA | |
| C. | 1.8gNH4+含有的质子数为NA | |
| D. | 标准状况下,2.24 L NO与1.12 L O2混合,所得气体中分子数为0.15NA |
7.通过下列方法,不可能将分子式为C2H6O的有机物的同分异构体,区别开来的是( )
| A. | 红外光谱 | B. | 核磁共振氢谱 | C. | 燃烧法 | D. | 与钠反应 |
8.在标准状况下,CO和C2H4混合气体100L,充分烧时耗用等体积的O2,则CO与C2H4的体积比是( )
| A. | 1:4 | B. | 4:1 | C. | 2:1 | D. | 1:2 |
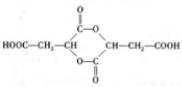 ;
;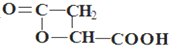 .
.