题目内容
2.有机物A和B只由C、H、O中的2种或3种元素组成,等物质的量的A与B分别完全燃烧时,消耗氧气的物质的量相等,则A与B相对分子质量之差(其中n为正数)不可能为( )| A. | 8n | B. | 18n | C. | 14n | D. | 44n |
分析 等物质的量的有机物消耗相等的物质的量的氧气有以下几种情况:①分子间相差n个CO2;②分子间相差n个H2O;③分子间1个C相当于4个H,即少n个C要多4n个H;④互为同分异构体,据此进行计算和判断.
解答 解:A与B的分子组成只相差n个“CO2”时,消耗氧气的量相等,即A和B的相对分子质量的差值为44n;
A与B分子组成只相差n个“H2O”时,消耗氧气的量相等,即A和B的相对分子质量的差值为18n;
由于分子间1个C相当于4个H,即少n个C要多4n个H时,消耗氧气的量相等,A和B的相对分子质量的差值12n-4n=8n;
当A与B互为同分异构体时,分子式相同,消耗氧气的量相等,则A和B的相对分子质量的差值为0;
根据分析可知,不可能的为C,
故选C.
点评 本题考查有机物耗氧量的判断,题目难度中等,注意利用有机物分子式的拆写简式耗氧量,注意有机物耗氧量的计算方法,试题培养了学生的分析、计算能力.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
13.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )


| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的酸性均减弱 | D. | 产生气泡的速率甲比乙慢 |
10.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 常温常压下,22.4 LCO2含有的原子数为3NA | |
| B. | 0.1 mol Na2O2固体含有的阴、阳离子总数是0.3NA | |
| C. | 1.8gNH4+含有的质子数为NA | |
| D. | 标准状况下,2.24 L NO与1.12 L O2混合,所得气体中分子数为0.15NA |
17.几种短周期元素的原子半径及主要化合价如表:
下列说法正确的是( )
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | X的最高价氧化物的水化物碱性比Y的弱 | |
| B. | Y既可以和酸反应又可以和碱反应,且化合价变化相同 | |
| C. | 常温下,Z单质可以与L的氢化物溶液反应置换出L单质 | |
| D. | X、M分别与Q形成的化合物中所含化学键类型相同 |
7.通过下列方法,不可能将分子式为C2H6O的有机物的同分异构体,区别开来的是( )
| A. | 红外光谱 | B. | 核磁共振氢谱 | C. | 燃烧法 | D. | 与钠反应 |
11.A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
(1)E在元素周期表中的位置第三周期第ⅥA族;
(2)B的最简单气态氢化物分子空间构型三角锥形;其沸点高于同主族的其它气态氢化物原因NH3分子间能形成氢键;
(3)D的最高价氧化物对应水化物的化学键类型离子键、共价键;
(4)B、C、D、E简单离子半径大小S2->N3->O2->Na+(用元素符号表示);
(5)由A、B、C与H元素组成的一种常见的酸式盐与过量的D的最高价氧化物对应的水化物反应的离子方程式NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O,在25℃,101kPa下,2gE单质在C2气体中完全燃烧后恢复到原状态,放热18.72kJ,该反应的热化学方程式S(s)+O2(g)=SO2(g)△H=-299.52kJ/mol.
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(2)B的最简单气态氢化物分子空间构型三角锥形;其沸点高于同主族的其它气态氢化物原因NH3分子间能形成氢键;
(3)D的最高价氧化物对应水化物的化学键类型离子键、共价键;
(4)B、C、D、E简单离子半径大小S2->N3->O2->Na+(用元素符号表示);
(5)由A、B、C与H元素组成的一种常见的酸式盐与过量的D的最高价氧化物对应的水化物反应的离子方程式NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O,在25℃,101kPa下,2gE单质在C2气体中完全燃烧后恢复到原状态,放热18.72kJ,该反应的热化学方程式S(s)+O2(g)=SO2(g)△H=-299.52kJ/mol.
12.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A. | 生成42.0L N2(标准状况) | |
| B. | 有0.250mol KNO3被氧化 | |
| C. | 转移电子的物质的量为1.25mol | |
| D. | 被氧化的N原子的物质的量为3.0mol |
 ,C的结构简式:
,C的结构简式: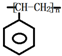 .
. .
.