题目内容
【题目】一定条件下正戊烷(CH3CH2CH2CH2CH3)易发生两种裂解反应:
I.CH3CH2CH2CH2CH3(g)![]() CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
II.CH3CH2CH2CH2CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
(1)维持体系温度T不变,总压强p恒定时,体积为V1L的正戊烷发生裂解反应,一段时间平衡后气体体积变为V2L,此时正戊烷的转化率α(正戊烷)=_______;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将______(填“增大”“减小”或“不变”),原因为_____________。
(2)一定温度下,向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5molCH3CH3发生反应CH3CH=CH2(g)+CH3CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
①△H3=________。
②5min内,该反应的平均反应速率v(CH3CH3)=________。
③保持温度不变,起始时向该密闭容器中充入等物质的量的CH3CH=CH2和CH3CH3,平衡后容器内CH3CH3的体积分数为______(保留一位小数)。
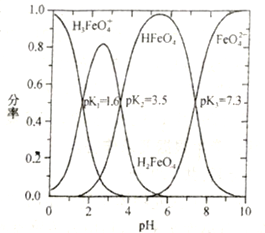
(3)将0.1molCH3CH3完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
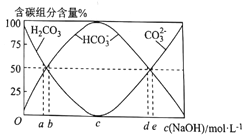
其中图中表示原氢氧化钠浓度为3mol.L-1的是_____(填“a”“b”“c”“d”或“e”)。
(4)以氢氧化钠溶液为电解质溶液,CH3CH3燃料电池的负极反应式为_________。
【答案】 ![]() 增大 充入水蒸气扩大容器体积,相当于减小压强,所以平衡向正向移动 -151.5kJ/mol 0.01mol/(L·min) 33.3% d( CH3CH3+18OH--14e-=2CO32-+12H2O
增大 充入水蒸气扩大容器体积,相当于减小压强,所以平衡向正向移动 -151.5kJ/mol 0.01mol/(L·min) 33.3% d( CH3CH3+18OH--14e-=2CO32-+12H2O
【解析】(1)等温、等压条件下,气体体积之比等于物质的量之比,正戊烷的转化率α(正戊烷)=![]() 。维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),容器体积增大,相当于减小压强,平衡正向移动,再次平衡后正戊烷的转化率将增大。
。维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),容器体积增大,相当于减小压强,平衡正向移动,再次平衡后正戊烷的转化率将增大。
(2)①根据盖斯定律可得:△H3=△H2-△H1=-151.5 kJ/mol。
②容器内剩余CH3CH=CH2的物质的量为0.1 mol,则消耗CH3CH=CH2的物质的量为0.1 mol,消耗CH3CH3的物质量也为0.1 mol,5 min内该反应的平均反应速率v(CH3CH3)=0.1mol/(2L×5 min)= 0.01mol/(L·min)。
③达到平衡时CH3CH=CH2(g)、CH3CH3(g)、CH3CH2CH3(g)、CH2=CH2(g)的物质的量分别为0.1mol、0.4mol、0.1mol、0.1mol,计算可得该温度下该反应的平衡常数K=0.25,保持温度不变,设向该密闭容器中充入CH3CH=CH2和CH3CH3各1mol,平衡后二者的物质的量均为(1-x)mol,CH3CH2CH3(g)和CH2=CH2(g)的物质的量均为x mol,带入平衡常数表达式:(x/2)2/((1-x)/2)2=0.25,可得x=1/3。平衡后容器内CH3CH3的体积分数为33.3%。
(3)将0.1 mol CH3CH3完全燃烧后的气体通入100 mL 3mol/L的NaOH溶液中,所得溶液为Na2CO3和NaHCO3物质的量之比为1:1的混合溶液,混合溶液显碱性,CO32-的水解程度大于HCO3-的水解程度,所以CO32-的物质的量比HCO3-略少,应选d点。
(4)以氢氧化钠溶液为电解质溶液,CH3CH3染料电池的负极反应式为CH3CH3+18OH--14e-=2CO32-+12H2O。