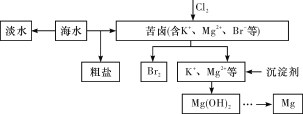
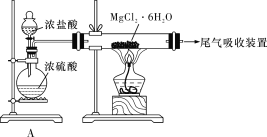
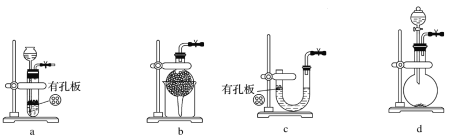
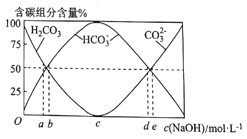
��Ŀ����
����Ŀ�����ĵ��ʼ�����������;�dz��㷺���ش���������:
��1��ij�ȵ�طŵ�ʱ�ܷ�ӦΪ4Li+FeS2==Fe+2Li2S���õ�ص������������Ϸֱ���_______��____��
��2��Na2FeO4��һ��������ˮ��������
��Na2FeO4�ɽ�ˮ����NH3ת��ΪN2����ȥͬʱ�������ɫ������1mol Na2FeO4�����ѳ�NH3�����ʵ���Ϊ______________________��
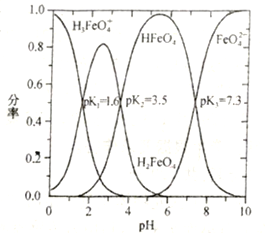
��Na2FeO4����ˮ����Һ�к���������������(ij����������������������������֮��)����ҺpH��ϵ����ͼ��ʾ(��֪�����£�H3FeO4+![]() H++H2FeO4��H2FeO4
H++H2FeO4��H2FeO4![]() H++HFeO4-��HFeO4-
H++HFeO4-��HFeO4-![]() H++FeO42-�ĵ��볣������ΪK1��K2��K3��pK=-lgK)��pH=3ʱ����Һ����Ҫ������Ũ�ȴӴ�С��˳��Ϊ________________����ӦFeO42-+H2O
H++FeO42-�ĵ��볣������ΪK1��K2��K3��pK=-lgK)��pH=3ʱ����Һ����Ҫ������Ũ�ȴӴ�С��˳��Ϊ________________����ӦFeO42-+H2O![]() HFeO4-+OH-��pK=______��
HFeO4-+OH-��pK=______��
��3��CO��ԭ����������ʱ���漰���·�Ӧ:
a.Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)��H1
3Fe(s)+4CO2(g)��H1
b.FeO(g)+CO(g) ![]() Fe(s)+CO2(g)��H2
Fe(s)+CO2(g)��H2
c.3Fe2O3(s)+CO(g) ![]() 2 Fe3O4 (s)+CO2(g)��H3
2 Fe3O4 (s)+CO2(g)��H3
d. Fe3O4 (s)+CO(g) ![]() 3FeO(s)+CO2(g)��H4
3FeO(s)+CO2(g)��H4
��ط�Ӧ���¶�����������CO����������Ĺ�ϵ����ͼ��ʾ:
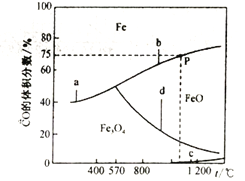
�ٷ�Ӧ����H>0����__________(ѡ��a��b��c��d)����H4 =_______(����H1����H2��ʾ)��
���ں����ܱ������У�����7.2gFeO��ͬʱ����0.1molCO�������¶�����ǡ�ô���ͼ��P�㴦��CO��ת����Ϊ_______�����������ɵ���Fe������Ϊ___________________��
���𰸡� FeS2 Li 1mol H2FeO4��HFeO4-��H3FeO4+ 6.7 d ��H1-3��H2 25% 1.4g
����������1������������ԭ��Ӧ��FeS2��õ�������Fe��S2����������������Ӧ��Liʧ��������Li+����˸õ�ص������������Ϸֱ���FeS2 �� Li����Ϊ; FeS2 �� Li
��2����Na2FeO4��NH3ת��ΪN2ͬʱ��������ԭΪFe3+�����ݵ�ʧ�������غ�ɵ�1mol Na2FeO4�����ѳ�NH3�����ʵ���Ϊ��![]() =1mol������ͼ���֪pH=3ʱ����Һ����Ҫ������Ũ��������H2FeO4����С����H3FeO4+�������м����HFeO4-��������Һ����Ҫ������Ũ�ȴӴ�С��˳��ΪH2FeO4��HFeO4-��H3FeO4+��FeO42-+H2O
=1mol������ͼ���֪pH=3ʱ����Һ����Ҫ������Ũ��������H2FeO4����С����H3FeO4+�������м����HFeO4-��������Һ����Ҫ������Ũ�ȴӴ�С��˳��ΪH2FeO4��HFeO4-��H3FeO4+��FeO42-+H2O![]() HFeO4-+OH-��K=
HFeO4-+OH-��K=![]() ����HFeO4-
����HFeO4-![]() H++FeO42-��K3=
H++FeO42-��K3=![]() ��K
��K![]() K3=
K3=![]() =
=![]() KW����֪K=
KW����֪K=![]() ����ͼ���֪pK3=-lgK3=7.3�����K3=10-7.3������K=
����ͼ���֪pK3=-lgK3=7.3�����K3=10-7.3������K=![]() =10-6.7��pK=-lgK=-lg10-6.7=6.7����Ϊ����1mol��H2FeO4��HFeO4-��H3FeO4+��6.7
=10-6.7��pK=-lgK=-lg10-6.7=6.7��������1mol��H2FeO4��HFeO4-��H3FeO4+��6.7
��3������ͼ���֪�����¶ȵ�����a��b��c�ķ�Ӧ��CO�İٷֺ�������˵��a��b��cΪ���ȷ�Ӧ��d��Ӧ��CO�İٷֺ�����С˵��dΪ���ȷ�Ӧ������֪����ʽ�����ݸ�˹���ɿɵ�d= a-3b��������H4 =��H1-3��H2�����ں����ܱ������У�����7.2gFeO��ͬʱ����0.1molCO���ɷ�����ӦFeO(s)+CO(g) ![]() Fe(s)+CO2(g)��P�㴦��CO�İٷֺ���Ϊ75%������xmol��CO���뷴Ӧ����
Fe(s)+CO2(g)��P�㴦��CO�İٷֺ���Ϊ75%������xmol��CO���뷴Ӧ����![]() =75%��x=0.025mol��CO��ת����Ϊ
=75%��x=0.025mol��CO��ת����Ϊ![]() �����������ɵ���Fe������Ϊ0.025
�����������ɵ���Fe������Ϊ0.025![]() =1.4 g����Ϊ����d����H1-3��H2��25% ��1.4g
=1.4 g��������d����H1-3��H2��25% ��1.4g

 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�