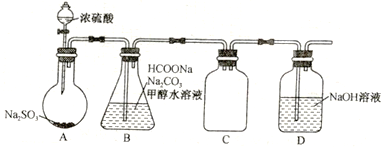
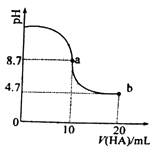
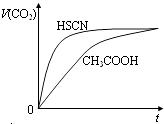
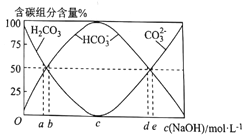
题目内容
【题目】如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是
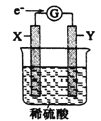
A. 外电路的电流方向为X![]() 外电路
外电路![]() Y
Y
B. 若两电极分别为Fe和碳棒,则X 为碳棒,Y 为Fe
C. X 极上发生的是还原反应,Y 极上发生的是氧化反应
D. 若两电极都是金属,则它们的活泼性顺序为X>Y
【答案】D
【解析】A. 根据电子的流向可知X是负极,Y是正极,外电路的电流方向为Y→外电路→X,A错误;B. 若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,B错误;C. 根据以上分析可知X极上发生的是氧化反应,Y极上发生的是还原反应,C错误;D. X是负极,若两电极都是金属,则它们的活泼性顺序为X>Y,D正确,答案选D。

练习册系列答案
相关题目