题目内容
【题目】我国天然气化工的一项革命性技术是甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃等化工产品。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):

(1)A、C分子中所含官能团的名称分别为____、_______。
(2)写出A的同分异构体的结构简式:_______。
(3)写出下列反应的化学方程式和反应类型。
反应①:__________,反应类型:_____________;
反应②:___________;反应类型: _____________;
反应③:_____________,反应类型:_____________。
(4)下图为实验室制取D的装置图。

①图中试剂a名称为_______,其作用是______________。用化学方程式表示试剂a参与的化学反应:______________。
②实验结束后从混合物中分离出D的方法为_____________。
【答案】 羟基 羧基 CH3OCH3 CH2=CH2+H2O![]() CH3CH2OH 加成反立 2CH3CH2OH+O2
CH3CH2OH 加成反立 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH
2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 酯化反应或取代反应 饱和碳酸钠溶液 溶解乙醇,去除乙酸,降低乙酸乙酯的溶解度 Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑ 分液
CH3COOCH2CH3+H2O 酯化反应或取代反应 饱和碳酸钠溶液 溶解乙醇,去除乙酸,降低乙酸乙酯的溶解度 Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑ 分液
【解析】根据框图分析推A为CH3CH2OH、B为CH3CHO、C为CH3COOH、D为 CH3COOCH2CH3结合物质之间的转化关系进行解答。
(1)根据上述分析A为CH3CH2OH、C为CH3COOH分子中所含官能团的名称分别为羟基和羧基。答案:羟基和羧基
(2)A为CH3CH2OH其同分异构体为甲醚,结构简式: CH3OCH3。答案:CH3OCH3。
(3)反应①是乙烯和水的加成反应,化学反应方程式为: CH2=CH2+H2O![]() CH3CH2OH,反应类型为加成反应;反应②是乙醇的催化氧化反应生成乙醛, 化学反应方程式为2CH3CH2OH+O2
CH3CH2OH,反应类型为加成反应;反应②是乙醇的催化氧化反应生成乙醛, 化学反应方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应类型为氧化反应;反应③是乙醇和乙酸的酯化反应,化学反应方程式为CH3CH2OH+CH3COOH
2CH3CHO+2H2O;反应类型为氧化反应;反应③是乙醇和乙酸的酯化反应,化学反应方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,反应类型为酯化反应或取代反应。
CH3COOCH2CH3+H2O,反应类型为酯化反应或取代反应。
(4)此装置为制乙酸乙酯的反应。①图中试剂a名称为饱和碳酸钠溶液,其作用是溶解乙醇,去除乙酸,降低乙酸乙酯的溶解度。试剂a为饱和碳酸钠溶液能与乙酸反应,此化学反应的方程式为: Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑。
②D为 CH3COOCH2CH3,因为乙酸乙酯是难溶于水且密度比水小的液体,可用分液的方法从混合物中分离出。答案:分液。

 阅读快车系列答案
阅读快车系列答案【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: . X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为 .
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号) .
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式) , 原因是 .
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式: .
(5)R的一种配合物的化学式为RCl36H2O.已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O
D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为: , 继续滴加氨水至过量,沉淀溶解, 得到天蓝色溶液,写反应的离子方程式为: .
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 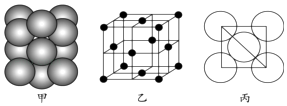
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为gcm﹣3(用字母表示).